- Tension de surface
-
Tension superficielle
 La tension superficielle permet à un pengő hongrois (aluminium) de ne pas couler au fond du verre d'eau
La tension superficielle permet à un pengő hongrois (aluminium) de ne pas couler au fond du verre d'eau
À la surface d'un milieu dense (liquide ou solide) ou à l'interface entre deux milieux denses, la matière n'est pas, localement, rigoureusement dans le même état. Ce nouvel état local est à une énergie légèrement supérieure. À la surface ou interface est donc associée une certaine énergie par unité de surface (exprimée en J/m2). Une autre façon d'exprimer la même chose consiste à dire qu'il existe, au voisinage de la surface ou interface, une certaine contrainte en tension dans le milieu ; c'est une force par unité de longueur, exprimée en N/m. On parle donc indifférement d'énergie ou de tension.
On a l'habitude, pour l'interface entre deux milieux denses, de parler de tension interfaciale, d'énergie interfaciale ou d'énergie d'interface. Entre un milieu dense et un gaz, on parle souvent plutôt de tension superficielle, de tension de surface ou d'énergie de surface.
Cet effet permet par exemple aux insectes de marcher sur l'eau, à un objet léger de se maintenir à la surface d'un liquide (illustration ci-contre), à la rosée de ne pas s'étaler sur les pétales de fleurs, et explique la capillarité. La tension superficielle explique aussi la formation des bulles de savon et la coalescence des gouttes ou des bulles.
Sommaire
Exemples simples et expériences
Un certain nombre d'expériences simples permettent de mettre en évidence la tension superficielle.
Forme d'une goutte
Dans le cas d'une goutte d'un liquide A au sein d'un liquide B, l'énergie est minimale lorsque la surface est minimale. Or, la forme correspondant à la plus petite surface possible est une sphère. C'est pour cela que les gouttes d'eau ont une forme sphérique. En réalité, la gravité joue également pour déterminer la forme de la goutte. Voir l'article sur les gouttes.
Coalescence de deux gouttes
Si deux gouttes se rencontrent, elles vont fusionner et ainsi former une seule goutte (coalescence), toujours pour minimiser l'énergie totale, produit de la tension superficielle par la surface totale. En effet, la surface totale du liquide est ainsi amoindrie.
Exemple de calcul pour deux gouttes de même rayon R.
Leur volume est proportionnel au cube R3 de leur rayon. Le volume de la goutte résultante est donc proportionnel à
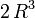 et a donc un rayon égal à
et a donc un rayon égal à 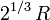 .
.Leur surface est égale à
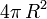 chacune, soit
chacune, soit 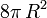 au total. La goutte résultante, quant à elle, a une surface
au total. La goutte résultante, quant à elle, a une surface 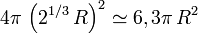 .
.Ainsi, la goutte résultante a une surface moindre que les deux gouttes initiales.
Ménisque de l'eau dans un verre
Lorsque l'on met de l'eau dans un verre, elle remonte d'environ un millimètre le long de la paroi ; ceci est particulièrement visible dans le cas d'un tube à essai (environ 1 cm de diamètre). C'est ce que l'on appelle un ménisque. À l'inverse, il est possible de faire dépasser la surface de l'eau du bord du verre sans qu'elle ne s'écoule en dehors de celui-ci.
Goutte qui pend sans tomber
C'est la tension superficielle qui retient la goutte au support ; la masse de la goutte qui tombe d'un compte-goutte est donnée par la loi de Tate
Action de la tension superficielle sur un fil souple

- Couper une bouteille en plastique,
- Poncer son bord de manière à faire disparaître les imperfections de la découpe,
- Percer deux trous diamétralement opposés à 5 mm du bord,
- Placer un fil légèrement détendu en travers de l'ouverture,
- Poser l'ouverture dans un récipient contenant de l'eau dans laquelle on a dilué un peu de liquide vaisselle, afin de créer une bulle,
- Rompre la partie inférieure de la bulle pour montrer que la force de tension superficielle qui minimise la partie supérieure est assez grande pour soulever le fil.
Propulsion à l'huile ou au savon

- Découper une pièce de plastique d'environ 3 cm (la colorer la rend plus facilement visible).
- Y découper une fente d'un millimètre de large.
- La poser sur l'eau d'un récipient.
- Déposer une goutte d'huile ou de savon liquide dans la fente. La pièce est propulsée par la force de tension superficielle.
On ne peut rééditer l'expérience sans changer l'eau contenue dans le récipient, car une seule goutte de liquide vaisselle abaisse tellement sa tension superficielle qu'une deuxième goutte ne peut à nouveau la diminuer suffisamment.
Fontaine de soda
Dans un soda, les molécules du gaz carbonique dissout sont solvatées, les molécules d'eau forment un bouclier autour du CO2 ; si l'on secoue la bouteille, on vainc la tension superficielle du bouclier et les molécules de CO2 se regroupent pour former des bulles ; ou bien en utilisant une poudre, les petits grains abaissent la tension superficielle, on peut par exemple mettre des chewing-gums (on obtient ainsi l'Effet geyser du mélange Mentos-boisson gazeuse).
Autres phénomènes
- Un liquide peut monter dans un tube fin : loi de Jurin
Méthodes de mesure de la tension superficielle
Voici quelques méthodes pratiquées couramment.
Méthode de la goutte pendante. Une goutte est observée de profil. Un ajustement précis de la forme par une famille de courbes connues, combiné à la taille de la goutte, permet de connaître la longueur capillaire. Connaissant la densité du liquide, on en déduit alors la tension de surperficielle.
Méthode de la plaque de Wilhelmy ou de l'anneau de du Nouy. On tire hors du liquide une plaque ou un anneau tout en mesurant la force exercée. On note la valeur de la force juste avant que le ménisque se détache. On divise la force ainsi obtenue par la largeur de la plaque ou par le périmètre de l'anneau, et on obtient la valeur de la tension superficielle modulo un facteur trigonométrique.
Méthode des encres test. On peut mesurer la tension de surface grâce à des encres test étalonnées. On trace un trait d'encre sur le matériau. Selon la réaction de l'encre on choisit l'encre d'un niveau supérieur ou inférieur et ainsi de suite jusqu'à ce que l'on trouve le niveau de tension superficielle du matériau.
Valeurs typiques
Les valeurs suivantes sont tirées du Polycopié de mécanique des fluides d'Henri Broch :
- interface eau/air
- 0 °C : σ = 76·10-3 N·m-1 ;
- 20 °C : σ = 73·10-3 N·m-1 ;
- 37 °C : σ = 70·10-3 N·m-1 ;
- interface (eau + surfactant pulmonaire)/air : 25·10-3 N·m-1 ;
- plasma sanguin, 37 °C : σ = 73·10-3 N·m-1 ;
- interface mercure/air, 20 °C : σ = 436·10-3 N·m-1.
Source : Flow Science inc.
- interface eau/huile à 20 °C : σ = 20·10-3 N·m-1 ;
Mécanisme
Interface liquide/gaz
Au sein d'un fluide (liquide ou gaz), les molécules exercent entre elles des forces d'attraction ou de répulsion : force de Van der Waals (attraction), force électrostatique (attraction ou répulsion). On parle de « forces intermoléculaires ».
Si l'on considère un corps pur liquide, composé d'un seul type de molécules, les molécules s'attirent (sinon, elles ne formeraient pas une phase). Au sein du liquide, chaque molécule est tirée dans toutes les directions par les molécules voisines de liquide : la résultante des forces est nulle.
Dans le vide, une molécule n'est, par contre, attirée par rien. Donc, à la frontière liquide/vide, les molécules sont attirées côté liquide mais pas côté vide ; la résultante des forces s'exerçant sur les molécules de la surface est donc dirigée vers l'intérieur du liquide. Ceci tend la surface.
- Dans le cas d'une interface liquide/vide, c'est donc un effet au sein d'un liquide qui amène la surface à se déformer comme une membrane élastique.
Mais on sait que soumis au vide, une partie du liquide s'évapore (voir l'article Pression de vapeur saturante). Si cette pression de gaz est faible, le liquide est soumis à une faible compression, et les molécules de la surface sont également soumises à une faible attraction de la part de leurs paires de la phase gazeuse ; mais la densité du gaz étant très inférieure à celle du liquide, cette attraction est négligeable.
Si maintenant il y a un autre gaz au-dessus (par exemple de l'air), le phénomène est similaire. Le liquide est soumis à la pression du gaz, et les molécules à la surface du liquide sont soumises à l'attraction ou à la répulsion de la part des molécules du gaz. Du fait de la faible densité du gaz par rapport au liquide, on néglige en général cette dernière contribution.
La forme de la surface résulte donc de l'équilibre entre la pression du gaz, l'attraction par l'intérieur du liquide, et le poids si l'on est en présence de pesanteur.
Le liquide peut être sous la forme d'une pellicule ; cette pellicule est alors soumise à la pression du gaz des deux côtés. Si les forces d'attraction au sein du liquide sont faibles, la pellicule ne tient pas. À l'inverse, si ces forces sont fortes, la pellicule tient bien et a un comportement élastique (bulle de savon).
Interface liquide/liquide
Lorsque deux liquides A et B sont miscibles, ils forment une seule phase. Par contre, s'ils sont non miscibles, ils forment deux phases séparées.
S'ils sont non miscibles, c'est que les molécules se repoussent. Les molécules situées à l'interface sont donc soumises :
- pour les molécules de A :
- à une attraction vers l'intérieur du liquide A ;
- à une répulsion de la part des molécules de B ;
- pour les molécules de B :
- à une attraction vers l'intérieur du liquide B ;
- à une répulsion de la part des molécules de A.
On voit donc que la résultante des forces est située vers l'intérieur de chacun des liquides dans tous les cas.
La forme de l'interface est donc déterminée par
- les forces d'attraction au sein des liquides, A/A et B/B ;
- la force de répulsion entre A et B ;
- la pesanteur le cas échéant.
C'est le cas de l'eau et de l'huile, de la vinaigrette :
- soit l'huile forme une couche au-dessus de l'eau ;
- soit l'huile forme des gouttelettes au sein de l'eau (émulsion).
Ligne triple : le contact solide – liquide – vapeur
On est souvent en présence de la ligne où se joignent trois interfaces, à la jonction de trois phases, par exemple solide/liquide/gaz. On appelle ligne triple cette jonction. Une ligne triple s'observe couramment, par exemple dans les situations suivantes :
- goutte posée sur un solide ;
- goutte suspendue à un solide ;
- bord d'un verre.
Les interactions liquide/gaz ont été décrites ci-dessus.
De même, les molécules du liquide peuvent être attirées ou repoussées par les molécules du solide. La forme de l'interface au niveau du point triple va donc être déterminée par :
- la force d'attraction au sein du liquide ;
- l'attraction ou la répulsion de la part du solide ;
- la pression du gaz, et éventuellement l'attraction ou la répulsion par le gaz ;
- la gravité.
S'il y a attraction entre le liquide et le solide :
- la goutte posée sur le solide va avoir tendance à s'étaler ;
- la goutte suspendue va être retenue ;
- le liquide va remonter le long du verre (ménisque, capillarité).
S'il y a répulsion entre le liquide et le solide :
- la goutte posée sur le solide va avoir tendance à « se regrouper », à prendre une forme sphérique ;
- la goutte suspendue va tomber ;
- le liquide va s'incurver vers le haut.
Des composés permettent de diminuer la tension superficielle, ce sont des tensioactifs.
Son importance en industrie
Pourquoi mesurer la tension superficielle ?
Il est capital dans l'industrie de connaître la tension superficielle d'un matériau. En effet, plus celle-ci est élevée plus le matériau sera apte à être imprimé ou collé par exemple. Au contraire plus le matériau a un niveau de tension de surface bas, plus il servira de filtre (hydrophobe voir oléophobe). La notion de tension superficielle est omniprésente notamment dans les industries plastiques, céramique ou métal.
- Pour le plastique : Il s'agit de savoir si on peut imprimer ou coller tel ou tel matériau, savoir si le matériau a été traité pour cela...
- Pour les métaux : Mesurer sert à savoir si le matériau est propre et donc apte au process.
Modélisation
La tension superficielle se mesure en newtons par mètre (N·m-1). On la définit comme la force qu'il faut appliquer à l'unité de longueur le long d'une ligne perpendiculaire à la surface d'un liquide en équilibre pour provoquer l'extension de cette surface, ou comme le travail exercé par cette force par unité de surface. L'unité de tension superficielle (N·m-1) est équivalente à des joules par mètre carré (J·m-2), qui correspondent à une unité d'énergie de surface. On peut définir cette énergie d'interface comme étant le surplus d'énergie chimique par rapport au cas où ces molécules se trouveraient à l'intérieur du liquide et non à sa surface.
Le système tend à minimiser l'énergie de surface.
Voir aussi
Articles connexes
- Loi de Jurin
- Pression de Laplace
- Capillarité
- Conditions de Plateau
- Effet lotus
- Gerridés (araignée d'eau)
- Surfactant pulmonaire
- Johnson, Kendall et Roberts
Liens externes
- Tension superficielle : gouttes, capillarité, bulles et surfusion
- Polycopié de mécanique des fluides, Henri Broch, p.13
- Flux de Marangoni
- Expériences scientifiques filmées
- (fr) Énergies de surface ou tensions superficielles des principaux polymères
- Portail de la physique
Catégories : Mécanique des milieux non homogènes | Thermodynamique
Wikimedia Foundation. 2010.


