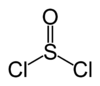
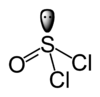
SOCl2
- SOCl2
-
Chlorure de thionyle
| Chlorure de thionyle |
  |
| Général |
| Nom IUPAC |
Dichlorure de thionyle |
| No CAS |
7719-09-7 |
| No EINECS |
231-748-8 |
| SMILES |
|
| InChI |
|
| Apparence |
liquide fumant incolore a jaune ou rouge, d'odeur acre.[1] |
| Propriétés chimiques |
| Formule brute |
Cl2OSSOCl2 |
| Masse molaire |
118,97 g∙mol-1
Cl 59,6 %, O 13,45 %, S 26,95 %,
|
| Propriétés physiques |
| T° fusion |
-104,5 °C[1] |
| T° ébullition |
76 °C[1] |
| Solubilité |
dans l'eau : réaction[1] |
| Pression de vapeur saturante |
à 25 °C : 16 kPa[1] |
| Précautions |
|
Directive 67/548/EEC
|

C
|
|
Numéro index :
016-015-00-0
Symboles :
C : Corrosif
Phrases R :
R14 : Réagit violemment au contact de l’ eau.
R29 : Au contact de l’ eau, dégage des gaz toxiques.
R35 : Provoque de graves brûlures.
R20/22 : Nocif par inhalation et par ingestion.
Phrases S :
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’ eau et consulter un spécialiste.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
(S1/2) : Conserver sous clef et hors de portée des enfants.
S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/ du visage.
|
| Phrases R : 14, 20/22, 29, 35, |
| Phrases S : (1/2), 26, 36/37/39, 45, |
|
Transport
|
Numéro ONU :
1836 : CHLORURE DE THIONYLE
|
|
NFPA 704
|
|
|
|
SIMDUT[2]
|
   D1A, E, F,
D1A, E, F,
D1A : Matière très toxique ayant des effets immédiats graves
létalité aiguë : CL50 inhalation/4 heures (rat) = 250 ppm
E : Matière corrosive
Transport des marchandises dangereuses : classe 8
F : Matière dangereusement réactive
réagit violemment au contact de l'eau en dégageant deux gaz très toxiques : chlorure d'hydrogène et dioxyde de soufre
Divulgation à 1,0% selon la liste de divulgation des ingrédients
|
|
SGH[3]
|

Danger
H302, H314, H332, EUH014, EUH029,
H302 : Nocif en cas d'ingestion
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H332 : Nocif par inhalation
EUH014 : Réagit violemment au contact de l'eau
EUH029 : Au contact de l'eau, dégage des gaz toxiques
|
| Écotoxicologie |
| DL50 |
500ppm (rats, inhalation) |
|
Unités du SI & CNTP, sauf indication contraire.
|
Le chlorure de thionyle, ou plus exactement dichlorure de thionyle a pour formule brute SOCl2, et a pour masse molaire 118.97 g.mol-1.
Synthèse
La plupart des synthèses industrielles du chlorure de thionyle utilisent la réaction entre le trioxyde de soufre et le chlorure de soufre.
- SO3 + SCl2 → SOCl2 + SO2
Parmi les autres méthodes, on peut citer :
- (a) SO2 + → SOCl2 +
- (b) SO2 + Cl2 + SCl2 → 2 SOCl2
- (c) SO3 + Cl2 + 2 SCl2 → 3 SOCl2
La réaction (a) a aussi pour produit de l'oxychlorure de phosphore, qui ressemble beaucoup au chlorure de thionyle dans de nombreuses réactions.
Utilisation
Le principal emploi du chlorure de thionyle est en réactif de chloration. Il permet notamment de transformer les alcools en chlorures d'alkyle, selon l'équation :
- ROH + SOCl2 → RCl + SO2 + HCl
De même, les acides carboxyliques sont transformés en chlorures d'acyle :
- RCO2H + SOCl2 → RCOCl + SO2 + HCl
Voir aussi
Liens externes
Références
 Portail de la chimie
Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique qui réagit avec l'eau | Chlorure | Arme chimique | Composé organo-sulfuré
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article SOCl2 de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
SOCl2 — Strukturformel Allgemeines Name Thionylchlorid Andere Namen Schwefligsäurechlorid Chlorthionyl Thionyldichlorid … Deutsch Wikipedia
Thionyl chloride — Thionyl chloride … Wikipedia
Cloruro de tionilo — Cloruro de tionilo … Wikipedia Español
7719-09-7 — Chlorure de thionyle Chlorure de thionyle Général … Wikipédia en Français
Chlorure De Thionyle — Général … Wikipédia en Français
ТИОНИЛГАЛОГЕНИДЫ — [дигалогениды сульфинила, ок сидигалогениды серы(IV)], соед. общей ф лы SOHal2, где Hal = Cl, Вr, F (см. табл.). Молекулы SOHal2 имеют пирамидальное строение. Для SOCl2 длины связей (нм) 0,207 (S Cl), 0,145 (SЧО), углы C1SC1 114°, OSCt… … Химическая энциклопедия
Тионилхлорид — Тионилхлорид … Википедия
Chlorure de thionyle — Struct … Wikipédia en Français
ХАЛЬКОГЕНЫ — ПОДГРУППА VIA. ХАЛЬКОГЕНЫ КИСЛОРОД Элемент кислород O восьмой элемент периодической системы элементов и первый элемент подгруппы VIA (табл. 7а). Этот элемент наиболее распространен в земной коре, составляя около 50% (масс.). В воздухе, которым мы … Энциклопедия Кольера
Halogenuros de alquilo — El Tetrafluoroetano, un haloalcano, se presenta como un líquido transparente que hierve por debajo de la temperatura ambiente, como se observa en la foto. Los halogenuros de alquilo, también conocidos como haloalcanos, halogenoalcano o haluro de… … Wikipedia Español








