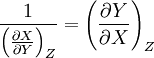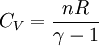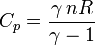- Relation de mayer
-
Relation de Mayer
La relation de Mayer, établie au XIXe siècle par Julius Robert von Mayer, est une des formules de thermodynamique parmi les plus importantes. Elle relie entre elles les capacités calorifiques à pression constante Cp et à volume constant CV :
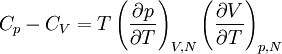 ,
,
où p, V, N et T sont respectivement la pression, le volume le nombre de particules et la température du système considéré.
DémonstrationLe résultat est une application simple des propriétés des dérivées partielles. La définition des capacités calorifiques s'écrit :
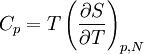 ,
,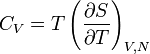 ,
,
L'entropie S pouvant s'écrire au choix comme une fonction de T, p, N ou T, V, N. Or le volume, la température, la pression et le nombre de particules sont reliés par l'équation d'état du système considéré. Ainsi, la fonction S(T,V,N) s'écrit-elle formellement
- S(T,V,N) = S(T,V(p,T,N),N) = S(T,p,N).
Ces deux formulations permettent d'obtenir deux versions de la dérivée de l'entropie par rapport à la température à pression et nombre de particules constants. La première, directement issue du fait que l'entropie peut être vue comme une fonction de la température et de la pression, s'écrit, par définition
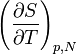 .
.
La seconde peut s'écrire en considérant que l'entropie est une fonction de la température et du volume, ce dernier étant une fonction implicite de la température et de la pression. Dans ce cas, en considérant le jeu de variables T et V, la dérivée de l'entropie par rapport à la température possède deux contributions, celle explicite de la forme
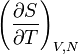 ,
,
et une autre, implicite, qui se calcule par la règle des dérivées emboitées, soit
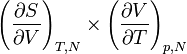 .
.
Au final, on obtient l'égalité suivante
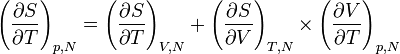 .
.
Ce résultat n'est rien d'autre que l'application des règles de dérivation qui régissent les fonction à plusieurs variables, il n'est lié à aucun aspect spécifique de la thermodynamique. En remplaçant par les définitions des capacités calorifiques, l'expression ci-dessus devient
 .
.
Le dernier terme peut être simplifié en considérant la différentielle de l'énergie libre F,
- dF = − SdT − pdV + μdN,
μ étant le potentiel chimique. Cette différentielle étant exacte, on a
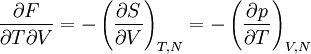 .
.
En reportant ceci dans l'expression de la relation de Mayer, il vient
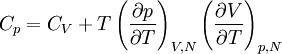 .
.
Sommaire
Autres écritures
En utilisant les propriétés des dérivées partielles, on peut réécrire la relation précédente en
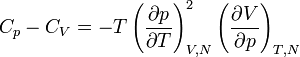 .
.
DémonstrationCeci provient immédiatement de la relation
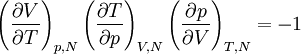 ,
,
dont on déduit
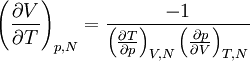 .
.
Utilisant ensuite la relation
pour les deux quantités du dénominateur, on obtient
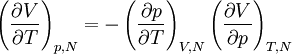 .
.
La nouvelle forme de la relation de Mayer se déduit en remplaçant le membre de gauche dans l'équation de départ.
Une écriture sans différentielle est également possible :
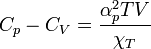 ,
,
où αp et χT sont respectivement le coefficient de dilatation isobare et le module de compressibilité isotherme.
Cas d'un gaz parfait
Pour un gaz parfait, d'équation d'état
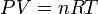 ,
,
où n est le nombre de moles du gaz et R la constante des gaz parfaits, on obtient immédiatement
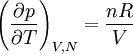 ,
,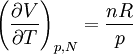 ,
,
d'où
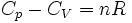 .
.
On obtient alors les expressions de CV et Cp en fonction de n, R et de γ :
Utilisation
La relation de Mayer permet en particulier de calculer CV connaissant Cp. En effet pour les liquides et les solides CV est difficile à obtenir expérimentalement alors que Cp ne pose pas de problèmes.
Cette relation est également utilisée pour calculer les fluctuations statistiques d'énergie dans une portion de gaz parfait.
Référence
- Claudine Guthmann, Danielle Lederer et Bernard Roudet, Éléments de physique statistique, 1996 [détail des éditions], page 753 et 754.
- Portail de la physique
Catégorie : Thermodynamique
Wikimedia Foundation. 2010.