- Recepteur des oestrogenes
-
Récepteur des œstrogènes
 Pour les articles homonymes, voir ER.
Pour les articles homonymes, voir ER.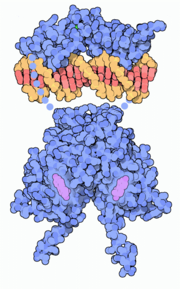 Modélisation d'un dimère de DBD (partie supérieure) et de LBD (partie inférieure) d'un récepteur des œstrogènes sur un élément de réponse d'ADN (en orange).
Modélisation d'un dimère de DBD (partie supérieure) et de LBD (partie inférieure) d'un récepteur des œstrogènes sur un élément de réponse d'ADN (en orange).
Les récepteurs des œstrogènes (ER) sont des protéines de la superfamille des récepteurs nucléaires, famille des récepteurs des stéroïdes, liant naturellement les œstrogènes, qui sont les principales hormones stéroïdes sexuelles féminines dans l'organisme.
Sommaire
Historique
Les récepteurs des œstrogènes furent initialement conceptualisés par Elwood V. Jensen à l'Université de Chicago à la fin des années 1950[1] ce qui lui valut d'être corécipiendaire du Prix Lasker en 2004. Il s'agissait à l'époque de la première identification d'un récepteur des hormones stéroïdes.
Structure
Les récepteurs ERα (ESR1, NR3A1) et ERβ (ESR2, NR3A2) sont deux protéines structurées par cinq régions communes à tous les récepteurs nucléaires. Ces régions sont nommées A/B, C, D, E et F et participent à la formation des domaines fonctionnels : le domaine N-terminal possèdant des fonctions de transactivation, le domaine de liaison à l'ADN (ou DBD), le domaine de dimérisation, le signal de localisation nucléaire (ou NLS) et le domaine de liaison du ligand (ou LBD). ERβ est plus court de séquence en acides aminés que ERα mais tous deux possèdent une similarité de structure dans les domaines DBD et LBD.
- Le domaine N-terminal (domaines A et B)
La région A/B constituant le N-terminal des ERs est impliquée dans des interactions protéine-protéine et participe, par le recrutement de cofacteurs transcriptionnels, à l’activation et l’expression des gènes cibles de l'œstradiol. Cette région contient une fonction d’activation de la transcription ou AF1 (Activation function) en plus de sites de phosphorylation fonctionnels. Le domaine AF1 est un domaine indépendant de la fixation de ligand au LBD. Mais l’activation complète par ERα et ERβ nécessite la fonction de transactivation AF2.
- Le domaine de liaison à l'ADN (domaine C)
Il correspond à la région C, qui est presque parfaitement conservée entre ERα et ERβ, et joue un rôle crucial dans la dimérisation et la fixation du ER à l’ADN. Ce domaine d'environ 60 acides aminés repliés en une forme globulaire contenant deux hélices α (dissimilaires par leurs séquences) perpendiculaire l’une sur l’autre et contenant chacune quatre résidus cystéines liant une atome de zinc par coordination : cette liaison forme deux régions en doigt de zinc qui portent les fonctions de fixation des récepteurs ERs à l'ADN.
Le DBD peut être défini par deux sous-domaines, différents par leurs structures et leurs fonctions. Le premier contient une boîte dite proximale ou P-box impliquée dans la fixation à l’ADN grâce à son interaction directe avec l’ADN au niveau des éléments de réponse des ERs appelés estrogen responsive elements ou ERE. Le deuxième sous-domaine du DBD contient une boîte dital ou D-box impliquée dans la dimérisation de deux molécules ER. La séquence P-box est identique entre le ERα et le ERβ ce qui explique que ces deux récepteurs fixent sur l’ADN par même affinité et spécificité. L’élément de réponse ERE est une répétition de la séquence 5’-AGGTCAnnnTGACCT-3’ (n correspond à n’importe quelle nucléotide). La séquence de D-box est différente entre les récepteurs et permet leurs dimérisation «head to head» grâce à complémentarité de structure et à des contacts entre les DBD impliquant les résidus Met42, Thr46, Thr50, et Ser58 du ER.
- La région charnière ou hinge (domaine D)
La région D est faiblement conservée et correspond à une région charnière flexible constituée d’un ensemble d’acides aminés basiques faisant le lien entre le domaine C et le domaine de liaison du ligand (domaine E/F). Elle contribue à la spécificité et la polarité de la fixation du récepteur à l’ADN. Ce domaine change de conformation après fixation du ligand et contient des sites de modification post-traductionnelle (telle que l'acétylation et une séquence de localisation nucléaire NLS qui permet au récepteur de migrer dans le noyau cellulaire.
- La région C-terminale (domaines E et F)
La région C-terminale des ERs est principalement constituée du domaine E, qui est à la fois le domaine de fixation du ligand, ou LBD (Domaine de liaison au ligand) et le site de la fonction de transactivation AF2. Le domaine E comporte aussi des régions impliquées dans la dimérisation des récepteurs. Sur le plan biochimique, le domaine E est structuré en une succession de douze hélices alpha amphipatiques (notées H1 à H12) séparées les unes des autres par des feuillets β. En absence de l’œstradiol, le LBD du ER fixe des corépresseurs transcriptionnels tels que SMRT ou NCoR, qui maintiennent le récepteur, tout au moins son AF2, dans un état transcriptionnellement inactif. À l’échelle moléculaire l’activation induite par la fixation de l’œstradiol se caractérise par un basculement de l’hélice H12 qui referme la poche de liaison du ligand et entraîne des ponts salins avec les autres hélices du domaine. Ce réarrangement est accompagné d’une compaction générale du LBD, entraînant la stabilisation du dimère de récepteurs sur les séquences régulatrices des promoteurs, un relargage des corépresseurs et la création de nouvelles surfaces d'interaction pour des coactivateurs.
Mécanismes d'action
Deux modes d'action principaux des ERs sont décrits: la voie génomique et la voie non-génomique.
- La voie génomique, la plus classique et la mieux connus, correspond à la situation où les ERs agissent comme des facteurs de transcription, à savoir quand ils se fixent au niveau des séquences régulatrices des gènes œstrogéno-régulés pour moduler leur expression. On parle de voie génomique directe ou indirecte selon que le récepteur se fixe directement sur les séquences d'ADN régulatrices ou via une interaction avec d'autres facteurs de transcription tels que les protéines AP-1 ou Sp1.
- Les voies non-génomiques correspondent aux effets des ERs sur les voies de signalisation intra-cellulaires, notamment calcium-dépendantes. Ces effets peuvent d'ailleurs se traduire également sur la régulation de gènes. En effet, de nombreuses cascades de signalisation influencent l'expression génique par l'intermédiaire de leurs composantes nucléaires.
Fonctions
Les récepteurs nucléaires des œstrogènes ERα et ERβ sont impliqués dans de nombreux processus physiologiques, notamment la fonction de reproduction, aussi bien chez le mâle que la femelle. L'invalidation du récepteur ERα conduit par exemple à la stérilité des souris femelles et mâles. À des degrés divers, les ERs exercent des fonctions au niveau du système nerveux central, du foie, des vaisseaux sanguins, du système immunitaire, des tissus adipeux et osseux.
Physiopathologie
La principale pathologie liée à un dérèglement du fonctionnement des œstrogènes et leurs récepteurs est le cancer du sein hormono-dépendant. En effet, près de 60% des tumeurs cancéreuses mammaires présentent initialement une croissance dépendante des œstrogènes. En revanche, alors que les effets prolifératifs des œstrogènes semblent clairement impliquer ERα, ERβ exercerait plutôt des effets anti-prolifératifs. Paradoxalement, les tumeurs ERα-positives sont souvent moins invasives que les tumeurs ER-négatives et leur pronostic est de fait généralement meilleur. Les tumeurs œstrogéno-dépendantes affectent également d'autres organes, notamment l'utérus (endomètre).
Bien que cela reste à démontrer clairement, les récepteurs ERα et ERβ seraient impliqués dans certains effets protecteurs des œstrogènes dans des maladies neuro-dégénératives telles que la maladie d'Alzheimer, ainsi que suite à certains accidents vasculaires cérébraux. Cependant, la découverte récente d'un troisième récepteur transmembranaire des œstrogènes[2] de la famille des récepteurs couplés aux protéines G, GPR30, complexifie le mécanisme d'action des récepteurs impliqués dans ces effets. De plus, GPR30 semble particulièrement abondant et actif au niveau du système nerveux central.
Références
- ↑ The estrogen receptor: a model for molecular medicine, Jensen EV, Jordan VC, Clin. Cancer Res. 2003;9,6:1980-9.
- ↑ A Transmembrane Intracellular Estrogen Receptor Mediates Rapid Cell Signaling Chetana M. Revankar, Daniel F. Cimino, Larry A. Sklar, Jeffrey B. Arterburn, Eric R. Prossnitz, Science, 11 March 2005:vol. 307. no. 5715, pp. 1625-1630.
Récepteurs nucléaires THR · RAR · PPAR · Rev-erb · ROR · EcR · LXR · FXR · VDR · PXR · CAR · HNF4 · RXR · Usp · COUP-TFI · ER · ERR · GR · MR · PR · AR · TR2/4 · NGFIB · NURR1 · NOR1 · SF1 · LRH1 · GCN1 · DAX1 · SHP Catégories : Récepteur nucléaire | Hormone sexuelle
Wikimedia Foundation. 2010.
