- Produit de solubilité
-
Le produit de solubilité est la constante d'équilibre correspondant à la dissolution d'un solide dans un solvant.
Sommaire
Définition
Soit par exemple la dissolution du solide ionique de formule XαYβ
La dissolution est décrit par la réaction suivante :

En utilisant la loi d'action de masse on obtient la formule :

- ax : activité de l'espèce x
Le composé ionique étant un solide pur ; son activité est donc égale à 1. Les activités des ions dans un milieu aqueux s'assimilent à leurs concentrations en mole par litre (mol/l).
Le produit de solubilité est :![K_s = \left[ X^{\beta+} \right] ^{\alpha} . \left[ Y^{\alpha-} \right] ^{\beta}](e/9ae67384ed649e2629a7833b48415ed4.png)
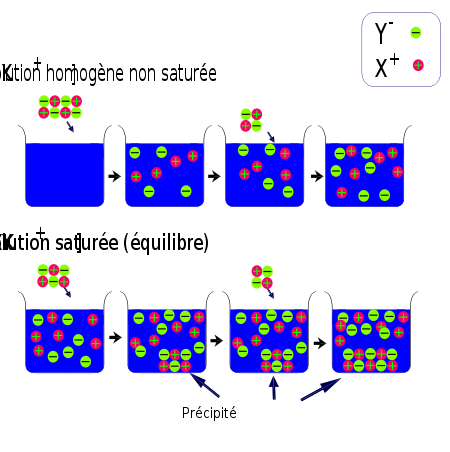 Illustration du produit de solubilité :
Illustration du produit de solubilité :
Si le produit des concentrations ( [X+].[Y-] ) des deux ions constitutifs du composé ionique reste inférieur à Ks, le composé ionique se dissocie entièrement.
Si le produit [X+].[Y-] est atteint, la solution est saturée et l'addition de composé ionique se traduit par un précipité. Une addition supplémentaire du composé XY, ne modifie pas la concentration en ions mais augmente la quantité de précipité.Produit de solubilité dans l'eau à 25 °C : exemples de valeurs numériques
Par ordre de solubilité décroissante
Formule Nom Ks NaCl Chlorure de sodium 38,98 TiBrO3 Bromate de titane 1,7 . 10-4 PbCl2 Chlorure de Plomb 1,6 . 10 -5 Ca(OH)2 Hydroxyde de calcium 5,5 . 10-6 TiBr Bromure de titane 3,4 . 10-6 NiCO3 Carbonate de Nickel 1,3 . 10 -7 CaC2O4 Oxalate de calcium 2 . 10-9 MnS Sulfure de manganèse 2,5 . 10-13 Cu(OH)2 Hydroxyde de cuivre 2,2 . 10-20 HgS Sulfure de mercure 4 . 10-53 La valeur du produit de solubilité dépend de la température. En général, elle croît avec la température.
Le produit de solubilité est un nombre sans dimension, il n'a donc pas d'unité. Le produit de solubilité n'est pas un produit de concentrations, mais un produit de valeurs numériques (en mol/L) de concentrations. Il s'agit d'une constante thermodynamique intervenant dans la Loi d'action de masse.
Relation entre le produit de solubilité et la solubilité
Attention : les relations et méthodes de calcul exposées dans ce paragraphe ne s'appliquent que dans le cas de la dissolution d'un seul composé ionique : si d'autres éléments sont déjà présents ou sont ajoutés, il faut en tenir compte. Exemple d'un composé ionique de type XY
Le bromure de cuivre se dissout dans l'eau suivant léquilibre suivant :

Soit s la solubilité du bromure de cuivre. La dissolution de s mole par litre de CuBr donne s mole par litre de Cu+ et s mole par litre de Br-. On peut décrire la situation de la manière suivante :

Espèce chimique CuBr Cu+ Br- t=0 excès 0 0 Équilibre excès s s Le produit de solubilité du bromure de cuivre s'écrit :
![K_s = \left[ Cu^+ \right] . \left[ Br^- \right] = 5,3 . 10^{-9}](d/b5d465d65e13c9c220facabaa6a57520.png)
Avertissement : une constante d'équilibre étant sans dimension, il convient en toute rigueur de l'équilibrer en la multipliant ou la divisant autant que nécessaire par la concentration standard C0 = 1mol.L − 1 soit :
![K_s = \frac{\left[ Cu^+ \right] . \left[ Br^- \right]}{{C^0}^2} = 5,3 . 10^{-9}](a/3cad1e861212f8a9c17b8aa26e6dea64.png)
On néglige en général ce terme en C° pour conserver la première écriture, même si l'équation aux dimensions est fausse.

donc

La masse molaire du bromure de cuivre est
MCuBr = 63,55 + 79,90 = 143,45g.mol − 1,
La solubilité massique du bromure de cuivre est

Exemple d'un composé ionique de type X2Y
Le carbonate d'argent se dissout suivant l'équilibre :

Soit s la solubilité du carbonate d'argent. La dissolution de s mole de AgCO3 donne 2s mole de Ag+ et s mole de CO3-. On peut décrire la situation de la manière suivante :

Espèce chimique Ag2CO3 Ag+ CO32- t=0 excès 0 0 Équilibre excès 2s s ![K_s = \left[ Ag^+ \right]^2 . \left[ CO_3^{2-} \right] = 8,1.10^{-18}](e/08edb33b7ee2b674d752523d4160fad4.png)

![s = \sqrt[3]{8,1.10^{-18}/4}](a/72affc1aa40658eda885783098341d64.png)
donc

La masse molaire du carbonate d'argent est

La solubilité massique du carbonate d'argent est

Généralisation
Soit la dissolution d'un composé ionique de formule générale XαYβ

Soit s la solubilité de XαYβ. La dissolution de s mole de XαYβ donne α s mole de Xα et β s mole de Yβ.. On peut décrire la situation de la manière suivante :

Espèce chimique XαYβ Xβ+ Yα- t=0 s 0 0 Équilibre 0 αs βs ![K_s = \left[ X^{\beta+} \right]^{\alpha} . \left[ Y^{\alpha-} \right]^{\beta}](e/9ae67384ed649e2629a7833b48415ed4.png)

La relation générale entre le K_s et la solubilité est la suivante :

Effet d’ion commun
Quel est le comportement d’un composé que l’on dissout dans une solution qui contient préalablement un ion de ce composé ?
Soit par exemple la dissolution du chlorure d’argent dans une solution d’acide chlorhydrique de concentration molaire 0,1 M. L’acide chlorhydrique étant un acide fort se dissocie complètement en cations H+ et anions Cl-. Le chlorure d’argent se dissocie suivant la réaction :

De manière qualitative en utilisant le principe de Le Chatelier, on montre que l’augmentation d’ion chlorure (donc à droite de l’équilibre) provoque un déplacement de l’équilibre vers la gauche. La présence d’ion chlorure diminue la solubilité du chlorure d’argent.
Exemple :
Dans l’eau pure la solubilité du chlorure d’argent est :

Espèce chimique AgCl Ag+ Cl- t=0 s 0 0 Équilibre 0 s s ![K_s = \left[ Ag^+ \right] . \left[ Cl^- \right]](1/cc1a145150e470a2d1e7846ec3062a99.png)


Si l’on dissout du chlorure d’argent dans la solution d’acide chlorhydrique 0,1 M la situation est la suivante :

Espèce chimique AgCl Ag+ Cl- t=0 s’ 0 0,1 Équilibre 0 s’ s’+0,1 ![K_s = \left[ Ag^+ \right] . \left[ Cl^- \right]](1/cc1a145150e470a2d1e7846ec3062a99.png)

On peut faire l’hypothèse que s est très faible devant 0,1. On peut alors écrire :



La solubilité du chlorure d'argent dans une solution d'acide chlorhydrique est inférieure à sa solubilité dans l'eau pure.
Vérification de l’hypothèse de calcul :
 . Il était possible de faire l’approximation.
. Il était possible de faire l’approximation.Attention : dans le cas contraire, si l’approximation n’est pas justifiée c'est-à-dire si les deux termes sont plus ou moins du même ordre de grandeur, il faut résoudre l’équation du deuxième degré afin de déterminer la solubilité
Wikimedia Foundation. 2010.


![a_{X^{\beta+} (aqueux)}^{\alpha} = \left[ X^{\beta+} \right] ^{\alpha}](f/53f84df4672e9f5ccbc5acada51f1e0d.png)
![a_{Y^{\alpha-} (aqueux)}^{\beta} = \left[ Y^{\alpha-} \right] ^{\beta}](9/849ee04092d168e5dce9c50ad6b0aa52.png)