- Oxyde de béryllium
-
Oxyde de béryllium 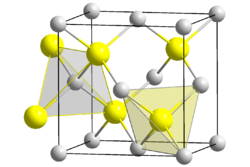
__ Be2+ __ O2-
Structure de l'oxyde de bérylliumGénéral No CAS No EINECS Apparence poudre ou cristaux blancs[1]. Propriétés chimiques Formule brute BeO Masse molaire[2] 25,0116 ± 0,0003 g·mol-1
Be 36,03 %, O 63,97 %,Propriétés physiques T° fusion 2 530 °C[1] T° ébullition 3 900 °C[1] Solubilité dans l'eau : nulle[1] Masse volumique 3,0 g·cm-3[1] Cristallographie Structure type wurtzite[3] Précautions Directive 67/548/EEC 
T+Phrases R : 25, 26, 36/37/38, 43, 48/23, 49, Phrases S : 45, 53, Transport - 1566 SGH[4] 

DangerUnités du SI & CNTP, sauf indication contraire. L'oxyde de béryllium est le composé chimique de formule BeO. C'est un oxyde cristallin de couleur blanche. C'est un isolant électrique doté d'une conductivité thermique supérieure à celle des autres non-métaux hormis le diamant, et supérieure également à celle de certains métaux. Il est aussi appelé glucine.
Sommaire
Préparation et réactions
L'oxyde de béryllium peut être obtenu par calcination du carbonate de béryllium BeCO3, par déshydratation de l'hydroxyde de béryllium Be(OH)2, ou encore par combustion du béryllium métallique :
- BeCO3 → BeO + CO2
- Be(OH)2 → BeO + H2O
- 2 Be + O2 → 2 BeO
A l'air libre, la combustion du béryllium métallique donne un mélange d'oxyde BeO et de nitrure Be3N2.
A noter que, contrairement aux oxydes des autres éléments de la même colonne, BeO est amphotère et non basique.
L'oxyde de béryllium est inerte à haute température (plus de 800 °C) mais peut être dissous dans le difluorure d'ammonium [NH4+](HF2-) aqueux ou dans une solution d'acide sulfurique H2SO4 concentré et de sulfate d'ammonium [NH4+]2(SO42-).
Structure
A température ambiante, l'oxyde de béryllium a une structure cristalline hexagonale de type würtzite, contrairement aux oxydes des autres éléments de la même colonne (MgO, CaO, SrO et BaO) qui ont une structure cubique.
A haute température, BeO adopte une structure tétragonale.
Applications
En vertu de ses propriétés particulières d'isolant électrique et de conducteur thermique, l'oxyde de béryllium a été utilisé dans de nombreuses pièces à semiconducteurs hautes performances, mais sa nocivité lui valent d'être à présent remplacé par des matériaux alternatifs dans ses applications courantes. Son caractère à la fois réfractaire et léger lui assure néanmoins une utilisation en astronautique dans les moteurs fusées, et l'ensemble de ses propriétés physiques est mis à profit dans les modérateurs de neutrons et les réflecteurs de neutrons des centrales nucléaires, ainsi que dans les pâtes thermiques[5].
Certains composants électroniques de puissance utilisent une céramique d'oxyde de béryllium comme dissipateur thermique entre le circuit intégré en silicium et la base métallique sur laquelle est monté le circuit afin de bénéficier d'une meilleure conductivité thermique qu'avec l'oxyde d'aluminium Al2O3.
BeO est également utilisé comme céramique de structure pour les lampes électroniques, les magnétrons et les lasers à gaz.
Dangerosité du BeO
L'oxyde de béryllium est un composé particulièrement cancérogène qui doit être manipulé avec de grandes précautions. Inhalé, il est susceptible de provoquer la bérylliose.
Notes et références
- OXYDE DE BERYLLIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., 2006, 346 p. (ISBN 0-387-26147-8)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Greg Becker, Chris Lee, and Zuchen Lin, « Thermal conductivity in advanced chips — Emerging generation of thermal greases offers advantages », dans Advanced Packaging, juillet 2005, p. pp.2–4 [texte intégral (page consultée le 2008-03-04)]
Wikimedia Foundation. 2010.
