- OsO4
-
Tétroxyde d'osmium
Tétroxyde d'osmium 
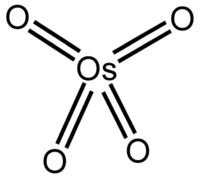
Général Nom IUPAC Tétroxyde d'osmium No CAS No EINECS Apparence solide de formes variables, incolore à jaune pâle, d'odeur acre.[1] Propriétés chimiques Formule brute OsO4 Masse molaire 254,23 g∙mol-1
O 25,17 %, Os 74,83 %,Propriétés physiques T° fusion 42 °C[1] T° ébullition 130 °C[1] Solubilité dans l'eau à 25 °C : 6 g/100 ml[1] Masse volumique (eau = 1) : 4.9[1] Pression de vapeur saturante à 27 °C : 1.5 kPa[1] Précautions Directive 67/548/EEC 
T+Phrases R : 26/27/28, 34, Phrases S : (1/2), 7/9, 26, 45, [2] Transport 66 2471 [3]SIMDUT[4] 


SGH[5] 

DangerUnités du SI & CNTP, sauf indication contraire. Le composé chimique tétroxyde d'osmium (OsO4) est un oxyde de l'élément chimique osmium dans lequel ce dernier atteint son état d'oxydation le plus élevé : +8. Lorsque de l'osmium est exposé sous forme de poudre à l'air, il s'oxyde en tétroxyde d'osmium qui se sublime à température ambiante. Cela donne un gaz extrêmement toxique et à l'odeur particulière. En fait, ceci explique le nom de l'élément venant du grec osme qui signifie « odeur ».
Applications
L'oxyde est un puissant colorant souvent utilisé dans la microscopie électronique en transmission (MET) pour donner du contraste à l'image. De la même manière, il peut colorer la cornée humaine, ce qui entraîne la cécité, lorsque les précautions nécessaires ne sont pas observées.
En synthèse organique, il est parfois utilisé pour oxyder les alcènes en diols, à l'instar du permanganate de potassium, utilisé dilué et à froid. Il est notamment impliqué dans la réaction catalytique appelée dihydroxylation de Sharpless, du chimiste Karl Barry Sharpless, prix Nobel de chimie 2001.
En biologie cellulaire, le tétraoxyde d'osmium est également utilisé pour colorer les saccules de la partie cis de l'appareil de golgi.
Risques
Cet oxyde est extrêmement toxique, même en très faible quantité, et doit être manipulé avec d'importantes précautions. En particulier, l'inhalation même à des concentrations trop faibles pour en percevoir l'odeur peut entraîner des œdèmes aux poumons, et causer la mort. Des symptômes détectables peuvent n'apparaître que plusieurs heures après l'exposition.
Le 6 avril 2004, l'agence de presse américaine ABC News rapportait que les services secrets britanniques auraient déjoué une attaque terroriste impliquant une bombe au tétroxyde d'osmium.
Références
- ↑ a , b , c , d , e et f TETROXYDE D'OSMIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ ESIS. Consulté le 30 novembre 2008
- ↑ Entrée du numéro CAS « 20816-12-0 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- ↑ « Tétroxyde d'osmium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé de l'osmium | Produit chimique très toxique | Produit chimique corrosif | Produit chimique comburant | Oxyde
Wikimedia Foundation. 2010.

