- Nomenclature des composés organiques
-
La nomenclature en chimie est l'ensemble des règles, symboles, vocables, destinés à représenter et à prononcer les noms des corps étudiés.
L'objectif essentiel d'une nomenclature est d'aboutir à des noms de composés chimiques sans ambiguïté, à savoir qu'un même nom ne doit jamais servir à désigner deux composés chimiques différents. Par contre, un même composé chimique suffisamment complexe peut recevoir plusieurs noms différents provenant de différentes nomenclatures, ou même parfois provenant de la même nomenclature.
La nomenclature officielle en chimie organique est la nomenclature IUPAC (Union internationale de chimie pure et appliquée).
Généralités
La connaissance d'une espèce en chimie organique revêt deux aspects :
- La structure qui est celle de la molécule, définie par la position relative dans l'espace des différents atomes (aspect statique).
- La réactivité, liée a la structure, qui rend compte du comportement vis-à-vis d'autres molécules (aspect dynamique).
Historique des tentatives de nomenclatures
Le besoin d'une nomenclature s'est fait particulièrement ressentir à la fin du XIXe siècle, devant les progrès de la chimie et le nombre de plus en plus important de molécules connues. Une commission internationale a été formée en 1889, composées principalement de français. Elle parvient à en finaliser des règles lors du congrès de Genève de 1892, connue sous le nom de nomenclature de Genève. Elle ne prend cependant pas en compte les molécules aromatiques, ni les composés ayant plusieurs fonctions.
Cette première nomenclature est précisée et complétée en 1930 sous le nom de nomenclature de Liège. Celle-ci sera amendée au cours de différents congrès internationaux, aboutissant à une nouvelle version, publiée en 1958 sous le nom de nomenclature de Paris[1].
Structure des molécules
Une molécule organique est composée :
- d'un squelette carboné constitué par des enchaînements carbonés aux formes diverses (chaîne, cycle, ...).
- de groupes fonctionnels caractéristiques des fonctions chimiques (alcool, acide, amine, etc.)
Pour chaque molécule, il faut établir la structure en s'appuyant sur des faits expérimentaux (preuves chimiques et spectroscopiques) et proposer une représentation par un symbolisme qui rend compte des différents types de liaison entre les atomes (double et triple liaisons, cycle) et aussi de la structure spatiale.
Noms des hydrocarbures
Alcanes
Les alcanes sont des hydrocarbures saturés (simples liaisons uniquement), linéaires (sans cycle) de formule brute CnH2n+2.
n alcane R-H reste formule CnH2n+2 alkyle R formule du reste abréviation 1 méth ane CH4 méth yle CH3- Meth(a) 2 éth ane CH3CH3 éth yle CH3CH2- Eth(a) 3 prop ane CH3CH2CH3 prop yle CH3CH2CH2- Prop(a) 4 but ane CH3(CH2)2CH3 but yle CH3(CH2)2CH2- But(a) 5 pent ane CH3(CH2)3CH3 pent yle CH3(CH2)3CH2- Pent(a) 6 hex ane CH3(CH2)4CH3 hex yle CH3(CH2)4CH2- Hex(a) 7 hept ane CH3(CH2)5CH3 hept yle CH3(CH2)5CH2- Hept(a) 8 oct ane CH3(CH2)6CH3 oct yle CH3(CH2)6CH2- Oct(a) 9 non ane CH3(CH2)7CH3 non yle CH3(CH2)7CH2- Non(a) 10 déc ane CH3(CH2)8CH3 déc yle CH3(CH2)8CH2- Déc(a) 11 undéc† ane CH3(CH2)9CH3 undéc yle CH3(CH2)9CH2- ? 12 dodéc ane CH3(CH2)10CH3 dodéc yle CH3(CH2)10CH2- ? 13 tridéc ane CH3(CH2)11CH3 tridéc yle CH3(CH2)11CH2- ? 14 tétradéc ane CH3(CH2)12CH3 tétradéc yle CH3(CH2)12CH2- ? 15 pentadéc ane CH3(CH2)13CH3 pentadéc yle CH3(CH2)13CH2- ? 16 hexadéc ane CH3(CH2)14CH3 hexadéc yle CH3(CH2)14CH2- ? 17 heptadéc ane CH3(CH2)15CH3 heptadéc yle CH3(CH2)15CH2- ? 18 octadéc ane CH3(CH2)16CH3 octadéc yle CH3(CH2)16CH2- ? 19 nonadéc ane CH3(CH2)17CH3 nonadéc yle CH3(CH2)17CH2- ? 20 icos ‡ ane CH3(CH2)18CH3 icos yle CH3(CH2)18CH2- ? 21 hénicos ane CH3(CH2)19CH3 hénicos yle CH3(CH2)19CH2- ? 22 docos ane CH3(CH2)20CH3 docos yle CH3(CH2)20CH2- ? 23 tricos ane CH3(CH2)21CH3 tricos yle CH3(CH2)21CH2- ? 30 triacont ane CH3(CH2)28CH3 triacont yle CH3(CH2)28CH2- ? 31 hentriacont ane CH3(CH2)29CH3 hentriacont yle CH3(CH2)29CH2- ? 32 dotriacont ane CH3(CH2)30CH3 dotriacont yle CH3(CH2)30CH2- ? 33 tritriacont ane CH3(CH2)31CH3 tritriacont yle CH3(CH2)31CH2- ? 40 tétracont ane CH3(CH2)38CH3 tétracont yle CH3(CH2)38CH2- ? 50 pentacont ane CH3(CH2)48CH3 pentacont yle CH3(CH2)48CH2- ? 60 hexacont ane CH3(CH2)58CH3 hexacont yle CH3(CH2)58CH2- ? 100 hect ane CH3(CH2)98CH3 hect yle CH3(CH2)98CH2- ? 132 dotriacontahect ane CH3(CH2)130CH3 dotriacontahect yle CH3(CH2)130CH2- ? † La forme hendécane n'est pas recommandée. ‡ La forme "eicos-" est désuète [1].
Alcanes ramifiés ou alkylalcanes
Ils sont constitués :
- d'un alcane de base qui est celui qui possède la chaîne hydrocarbonée la plus longue ;
- de ramifications alkyles (chaînes hydrocarbonées plus courtes) qui peuvent à leur tour être ramifiés.
Pour nommer un hydrocarbure ramifié, on désigne les chaînes latérales par des préfixes accolés au nom de l'hydrocarbure de base.
Nommer un alkylalcane dont la formule est donnée
- trouver la chaîne hydrocarbonée la plus longue à considérer comme l'alcane de base et lui donner un nom
- identifier tout groupe alkyl branché sur l'alcane et lui donner un nom (radical); placer ce nom en préfixe devant le nom de l'alcane de base en respectant l'ordre alphabétique.
- faire précéder le nom de chaque radical par un chiffre indiquant la position de la ramification sur l'alcane de base ; la numérotation de l'alcane de base se fait d'un bout à l'autre de façon à ce que la somme des indices soit la plus faible possible. L'indice (il y en a autant que de ramifications) est toujours placé devant le nom auquel il se réfère.
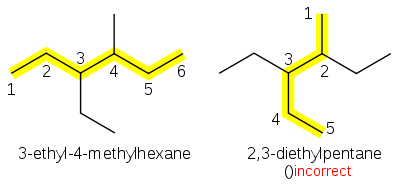
- Exemple
- 3-éthyl-4-méthylhexane :
En cas de choix de numérotation des substituants, on doit donner l'indice le plus bas au radical prioritaire par ordre alphabétique.
Écrire la formule chimique d'un alcane dont le nom est donné
- écrire autant de carbones que l'exige le nom de l'alcane de base et numéroter chacun de ses atomes ;
- faire de même avec les radicaux en les positionant sur l'alcane de base selon le numero du carbone porteur sur l'alcane de base.
Principaux radicaux ramifiés

Autres radicaux
Les cycloalcanes
- Les alcanes monocycliques de formule brute CnH2n sont nommés en faisant précéder du préfixe cyclo le nom de l'alcane.
- Exemples : cyclobutane, cycloheptane, 1,1,3-triméthylcyclopentane.
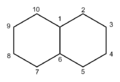
- Les alcanes bicycliques prennent le nom de l'alcane linéaire de même nombre de carbones précédé du préfixe bicyclo. Après ce préfixe, on met entre crochets le nombre d'atomes de carbone de chacun des 3 ponts séparés par des points. On numérote les atomes du cycle à partir d'une tête de pont en numérotant en premier la chaine la plus longue conduisant à l'autre tête de pont, on continue en numérotant la chaine moyenne en revenant vers la première tête de pont puis on termine par la plus courte.
-
bicyclo[4.4.0]décane ou décaline
Les hydrocarbures insaturés
On parle d'hydrocarbure insaturé lorsque certaines liaisons entre les atomes de carbone du squelette carboné sont doubles ou même triples, les autres étant simples
Les alcènes
Formule brute de la forme CnH2n pour les chaines portant 1 seule double liaison (pour plusieurs doubles liaisons cette formule n'est pas utilisable).
Les alcènes contiennent au moins une liaison C-C double. Le nom d'un alcène est calqué sur celui des alcanes : le suffixe -ane est remplacé par le suffixe -ène et la position de la double liaison doit être précédée d'un indice de position le plus bas pour le premier carbone de la liaison. Les hydrocarbures portant 2 doubles liaisons sont appelés alcadiènes.
Exemples
- CH3-CH2CH=CH2 but-1-ène
- CH3CH=CHCH2CH=CHCH3 hepta-2,5-diène
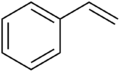
Groupes dérivés des alcènes
- les groupes alcényles
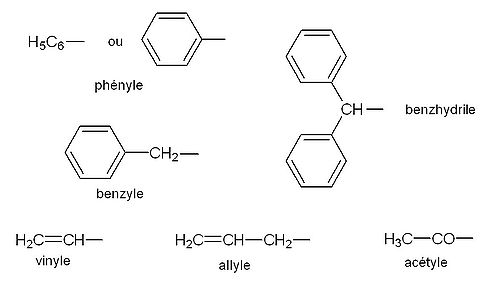
- CH2=CH- éthényle ou vinyle
- CH2=CH-CH2- prop-2-ényle ou allyle
- Les groupes alkylidènes
- CH3CH= éthylidène
- les groupes alkylènes : groupes divalents dérivés des alcanes par élimination d'un hydrogène à chaque extrémité de la chaine
- -CH2- méthylène
- -CH=CH- vinylène
Les alcynes
Les alcynes contiennent au moins une liaison C-C triple. Le nom d'un alcyne est obtenu à partir du nom de l'alcane en remplaçant le suffixe -ane par le suffixe -yne. La numérotation des carbones s'effectue de la même façon que pour les alcènes.
Exemples d'alcènes et d'alcynes
Les hydrocarbures aromatiques
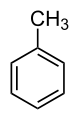
Les plus courants sont en général dérivés du benzène.
Les hydrocarbures désignés par un nom trivial
Exemples :
Cas des dérivés du benzène disubstitué
- en position 1,2 position ortho (o)
- en position 1,3 position méta (m)
- en position 1,4 position para (p)
Exemples : o-dichlorobenzène, p-bromotoluène.
Les hydrocarbures aromatiques forment des groupes aryles :
Les hydrocarbures aromatiques polycycliques
Exemples d'hydrocarbures aromatiques polycycliques (HAP) connus :
Dérivés fonctionnels des hydrocarbures
Les fonctions organiques sont signalées dans la composition du nom d'un dérivé polyfonctionnel d'hydrocarbure soit par un préfixe soit par un suffixe.
- La fonction principale est en suffixe.
- Toutes les autres fonctions sont en préfixe selon une hierarchie définie.
Fonctions organiques toujours signalées en préfixe
Fonction Préfixe -Br bromo -Cl chloro -N=N- diazo CH3CH2O- éthoxy -F fluoro -I iodo CH3O- méthoxy -NO2 nitro -NO nitroso Principales fonctions organiques classées par ordre de priorité décroissante
Fonction Si prioritaire Si non prioritaire → suffixe → préfixe Acide carboxylique -oïque -n°-carboxy... Sel d'acide -oate -n°-acyloxy... Halogénure d'acyle -oyle -n°-halogénoformyle Nitrile -nitrile -n°-cyano... Aldéhyde -al -n°-formyl... Cétone -n°-one -n°-oxo... Alcool -n°-ol -n°-hydroxy... Amine -n°-amine -n°-amino... Halogène -ure -n°-halogéno... Voir aussi
Liens externes
- (en) IUPAC : Nomenclature de la chimie organique
- (fr) L'assistant IUPAC: aide à la nomenclature des molécules organiques en français
Notes et références
- Jaussaud P, Présence de l'histoire : Comment nommer les molécules organiques ?, Pous la Science, septembre 2007, p 8-12
Wikimedia Foundation. 2010.