- Nomadacris septemfasciata
-
Criquet nomade
Acrididae

Nomadacris septemfasciata Classification classique Règne Animalia Embranchement Arthropoda Sous-embr. Hexapoda Classe Insecta Sous-classe Dicondylia Infra-classe Pterygota Division Neoptera Super-ordre Orthopterida Ordre Orthoptera Sous-ordre Caelifera Infra-ordre Acrididea Super-famille Acridoidea Famille Acrididae Sous-famille Cyrtacanthacridinae Genre Nomadacris Nom binominal Nomadacris septemfasciata
(Serville, 1838)Parcourez la biologie sur Wikipédia : Le Criquet nomade ou Criquet rouge (Nomadacris septemfasciata) est une espèce de criquet de la famille des Acrididae, qui se rencontre en Afrique.
L'espèce est considérée comme nuisible de part les ravages qu'elle peut faire sur les plantes.
Sommaire
Morphologie
- Taille des ailés mâles : 6 à 7 cm.
- Taille des ailés femelles : 6 à 8,5 cm.
Répartition
L’aire de distribution de Nomadacris septemfasciata est essentiellement sud-africaine (Anonyme (FAO) 1967, Anonyme (COPR) 1982). Elle comprend les régions équatoriales et tropicales situées du Cap de Bonne Espérance jusqu’au Congo et à la Tanzanie. Lors de la dernière grande invasion dans les années 1940, des vols remontèrent au-delà de l’équateur jusqu’en Éthiopie, à l’Est, et les bords du lac Tchad à l’Ouest. Le manuel du COPR (1982) donne une carte récente de son aire de distribution. Outre l’Afrique au sud de l’équateur et les îles de l’océan Indien, des populations isolées sont également connues dans le bassin du lac Tchad, le delta central du fleuve Niger au Mali ainsi que dans les îles du Cap-Vert.
Biologie
Le criquet nomade a un cycle biologique univoltin (voir figure ci-dessous). Il développe une génération par an avec une diapause imaginale pendant la saison sèche (Frappa 1935). On peut opposer deux périodes fondamentales : la diapause imaginale en saison sèche, et la reproduction en saison des pluies.
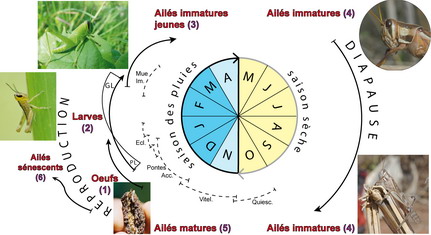
La diapause est un arrêt régulier obligatoire du développement d’un insecte (Danks 1987). C’est une stratégie permettant à l’espèce de survivre pendant la période la plus défavorable du cycle (Denlinger 1986). La diapause imaginale maintient les imagos à l’état immature pendant toute la saison sèche, elle se traduit par le blocage du développement ovarien des femelles. L’induction de la diapause est liée à la photopériode (diminution de la durée du jour entre mars et juillet (Norris 1965). La diapause est levée par une combinaison d’autres facteurs : passage par des températures fraîches en août, remontée des températures en septembre, arrivée des premières pluies entre octobre et novembre (Robertson 1958).
La reproduction a lieu en saison des pluies. Cette période physiologique est relativement complexe. Elle regroupe plusieurs étapes successives qui vont de l’imago mature jusqu’au jeune imago de la génération suivante :
- Les imagos matures se reproduisent entre novembre et décembre (Frappa 1935, 1936, 1938).
- Les femelles pondent dans le sol de 80 à 200 œufs selon leur phase (Albrecht 1956). Elles pondent entre 1 et 3 fois, rarement plus (Stortenbeker 1967). La durée de l’inter-ponte varie de 15 jours (Burnett 1951b) à 20 jours (Robertson 1958).
- Les premières larves éclosent entre fin décembre et début janvier. Les éclosions s’étalent jusqu’à début février dans le sud-ouest et l’ouest malgache (Frappa 1948). Les larves passent par 6 à 7 stades chacun séparé par une mue. Au 5e stade, s’effectue le retournement des ébauches alaires (ptérothèques) (Têtefort & Wintrebert 1963). Le développement larvaire dure de 50 à 70 jours (Randrianasolo 1978).
- Les jeunes imagos apparaissent au mois de mars. Au bout de 10 à 20 jours ils ont durcit leur tégument et peuvent voler (Têtefort & Wintrebert 1967).
Comportement
Le criquet nomade a un comportement semi-arboricole. Il privilégie les environnements herbacés souvent embroussaillés et denses avec de hautes graminées. En saison sèche, il utilise des perchoirs arbustifs voire arborés.
Alimentation
Le criquet nomade est un ravageur polyphage. Têtefort & Wintrebert (1967) et Faure (1935) notent que les plantes suivantes sont consommées par les solitaires : grandes graminées (maïs, canne à sucre, sorgho), palmiers (Hyphaene shatan, Bismarkia nobilis), bambou, bananier, tabac, les citrus, choux, tomates, laurier rose, manguier, sisal, manioc et euphorbes arbustives…
Ecologie
Le criquet nomade est un acridien méso-hygrophile. Les biotopes des imagos de N. septemfasciata sont généralement des savanes hautes et denses arborées ou buissonneuses (Descamps & Wintrebert 1966, Randrianasolo 1978). La forêt n’est jamais colonisée.
La durée d’incubation des œufs est relativement longue 20 à 35 jours selon les conditions thermo-hydriques. Par ailleurs, la ponte, au début de la saison des pluies, se déroule dans une période météorologique instable. Le risque majeur vient de l’inondation des œufs en cas de pluies précoces et brutales. D’un autre coté une période de sécheresse pourra nuire au développement embryonnaire, jusqu’à tuer l’embryon. Le choix d’un site de ponte est donc crucial du point de vue de la dynamique des populations puisque c’est l’unique période où une population peut multiplier ses effectifs, sans apport de populations allochtones.
Les biotopes de développement des larves et des jeunes ailés sont sensiblement les mêmes que les zones de ponte. Si des zones de pontes sont inondées par la suite, les larves peuvent se développer en haut de strate herbeuse (Bredo 1938b, Burnett 1951a).
Ennemis naturels
Des acariens rouges, du genre Eutrombidium, peuvent être abondants sur les ailes, mais ont peu de conséquences sur la physiologie du criquet (Anonyme (COPR) 1982). Têtefort & Wintrebert (1963, 1967) et Descamps & Wintrebert (1966) soulignent que les larves de Stomorhina lunata (diptère, Calliphoridae), de Mylabris (coléoptère, Tenebrionoidea, Meloidae) et de Scelio howardi et S. zolotarevskyi (hyménoptères, Scelionidae) sont de redoutables prédateurs d’oothèques du criquet nomade. Le parasitisme par les Scelionidae (S. horwardi en particulier), par les acariens et la prédation par des larves de diptères Bombyliidae (Anastoechus sp.) ne contribueraient à la mortalité que de manière anecdotique. Têtefort & Wintrebert (1967) notent que les premiers stades larvaires sont les plus attaqués. De nombreux prédateurs sont cités : fourmis, araignées, batraciens (Ptychadena mascareniensis) et des reptiles lacertiliens (Chalarodon madagascariensis, Oplurus cyclurus, Chamaeleo sp.). A Madagascar, Oplurus cuvieri, un lézard de grande taille (15 à 25 cm) est localement abondant et se nourrit de larves et d’imagos de criquet nomade. Beaucoup d’observations ont été effectuées sur l’impact des oiseaux sur les pullulations du criquet nomade, mais hormis quelques cas localisés, leur capacité à influer significativement sur le devenir d’une invasion est négligeable. Milans (Milvus migrans ægyptius), crécerelles (Falco newtoni), guêpiers (Merops superciliosus), faucons concolores (Falco concolor) sont cités par Frappa (1935). En Tanzanie, Vesey-Fitzgerald (1954) a démontré que les déplacements de cigognes (Ciconia ciconia) durant les invasions sont largement dépendants de la présence et des déplacements des essaims de criquets. Le martin triste (Acridotheres tristis), après l’île Maurice, a été introduit à Madagascar dans la deuxième moitié du XIXème siècle pour la lutte contre le criquet nomade, là aussi sans grand succès (Hemming 1964). À noter, enfin, que le héron garde-bœufs (Bubulcus ibis) forme des regroupements de haute densité qui se déplacent à la recherche de nourriture dans les endroits infestés de criquets.
Kooyman (1999) recense les agents pathogènes champignons, bactéries, nématodes et protozoaires, collectés dans la nature et susceptibles d’être utilisés en lutte biologique. A ce jour seul le champignon Metarhizium anisopliae a fait l’objet d’essais à grande échelle (Price et al. 1999, Van der Walk 2007)
Phases
Jusqu’à 1921, Locusta migratoria et Locusta danica étaient considérés comme deux espèces différentes. Uvarov (1921) a montré qu’il s’agissait de deux formes différentes d’une même espèce : l’une caractérisant les populations grégaires et l’autre les populations solitaires. Le terme de phase est employé par analogie avec les différents états d’une même substance, comme l’eau ou l’air, qui suivent des lois physiques et chimiques différentes. Les différences phasaires chez les acridiens sont profondes : le comportement, la pigmentation, la morphologie, la physiologie et l’anatomie sont affectés. Les changements de phase sont gradués en fonction du choc densitaire subi. Les formes intermédiaires sont appelées transiens. Dans le cas d’une évolution de la forme solitaire vers la forme grégaire, on parle de transiens congregans et dans le cas inverse de transiens dissocians (ou degregans) (Uvarov 1966). En phase solitaire un locuste est inoffensif pour les cultures principalement à cause de la faible densité des populations et d’un choix alimentaire plus restreint que les grégaires qui sont plus euryphages et vivant groupés, causent des ravages sur la végétation. Le criquet nomade est un de ces locustes. Cet acridien est dit « grégariapte ».
Faure (1935) est le premier à expliquer le processus de transformation phasaire chez le criquet nomade. Les formes solitaires et grégaires se distinguent l’une de l’autre par le comportement, la pigmentation, la morphologie puis par l’écologie.
Les grégaires imitent les gestes de leurs congénères et maintiennent activement le groupement en bandes larvaires ou en essaims ailés. A l’inverse, les solitaires vivent isolés, sauf en cas de rapprochement sexuel ou de rassemblement fortuit sur les plantes ou sur les sites favorables. Les ailés solitaires volent de préférence le soir où la nuit et les grégaires le jour (Chapman 1959b). Les températures fortes et les ascendances thermiques de jour permettent aux grégaires de voler plus haut et plus longtemps et donc de parcourir de plus grandes distances (Farrow 1990).
Les larves solitaires sont de couleur verte plus ou moins claire ou foncée et plus ou moins mouchetées de brun ou de noir, en particulier sur le pronotum et les ébauches alaires. Les larves grégaires ont une teinte contrastée : un fond jaune plus ou moins orangé, maculé de noir. Les imagos grégaires sont de couleur beige en diapause, à l’identique des solitaires. Mais les grégaires jaunissent à la maturation sexuelle et deviennent marrons lie de vin en vieillissant (Michelmore & Allan 1934, Faure 1935).
La forme du pronotum ne varie pas chez le criquet nomade, au contraire du criquet migrateur et du criquet pèlerin (Albrecht 1956). Le fémur postérieur des solitaires est plus long que celui des grégaires, mais les élytres sont plus courts chez les solitaires que chez les grégaires (Bredo 1938a). De plus, le dimorphisme sexuel s’atténue chez les grégaires. Alors que le mâle est plus petit que la femelle chez les solitaires (les mâles sont de l’ordre de 60 mm et les femelles de 80 mm), les deux sexes ont sensiblement la même taille chez les grégaires (Stortenbeker 1967).
Le délai de maturation sexuelle chez les groupés est inférieur à celui des isolés par effet de synchronisation au niveau du groupe (Norris 1959). Le potentiel biotique évolue aussi. Le nombre d’ovarioles des femelles solitaires varie entre 130 et 200, alors qu’il est seulement de 50 à 150 chez les grégaires (Robertson 1958, Uvarov 1966, Têtefort & Wintrebert 1967). Les grégaires pondent donc moins d’œufs, mais ces œufs sont plus gros et plus résistants à l’inondation (Albrecht 1955, 1959). Le poids des jeunes larves grégaires est plus important. Les larves grégaires font une mue de moins et ont donc une durée de développement plus court : environ 50 jours contre 60 à 70 pour les solitaires (Hamilton 1936). Globalement les solitaires ont des exigences écologiques plus strictes et sont plus sélectifs et adaptés au micro-milieu (Duranton com. pers.). Les grégaires sont plus tolérants, adaptés et dépendants du macro-milieu (Uvarov 1977).
Philatélie
- La lutte contre ce criquet est commémorée par une émission de l'Angola de 1963 (valeur faciale : 2,50 $).
Références
http://www.cirad.fr/ur/acridologie
http://agents.cirad.fr/index.php/alex.franc
Photo

- Portail de la zoologie
Catégories : Orthoptère (nom vernaculaire) | Locuste
Wikimedia Foundation. 2010.
