- Mauvéine
-
Mauvéine 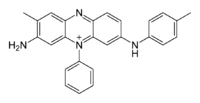
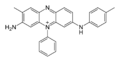
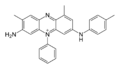
Structure de la mauvéine A Général No CAS Propriétés chimiques Formule brute C26H23ClN4 Masse molaire[1] 426,941 ± 0,025 g·mol-1
C 73,14 %, H 5,43 %, Cl 8,3 %, N 13,12 %,Unités du SI & CNTP, sauf indication contraire. La mauvéine fut le premier colorant industriel synthétique. Son nom chimique est l'acétate de 3-amino-2,±9-diméthyl-5-phényl-7-(p-tolylamino)phénazinium. Sa formule est C26H23N4+X− (pour la mauvéine A) et C27H25N4+X− (pour la mauvéine B).
Sommaire
Histoire
À Londres en 1856, William Henry Perkin, âgé de 18 ans, travaille sur une forme synthétique de la quinine dans le but de trouver une substance anti-malarienne, pour un concours lancé par son professeur August Wilhelm von Hofmann. S'il n'arrivera pas à synthétiser la quinine, il fera par contre une découverte intéressante. Au cours de ses essais, il oxyde l'aniline par le dichromate de potassium. Dans ces conditions, l'aniline réagit avec les impuretés de toluidine présentes dans le mélange pour produire un solide noir, résultat bien souvent obtenu lors d'échecs de synthèses organiques. Cependant, alors qu'il essayait de récurer cette pâte goudronneuse, Perkin découvrit que certains composants étaient solubles dans l'alcool et donnaient une solution violette, ce qui prouvait son efficacité en tant que colorant pour la laine ou la soie.
Perkin brevette sa découverte, et commercialise la mauvéine qu'il fait fabriquer dans la première usine de colorant de synthèse à avoir jamais existé, à Greenford Green, près de Greenford, à environ 15 km à l'ouest du centre de Londres. Six ans plus tard, en 1862, la reine Victoria apparaît à la Royal Exhibition dans une robe en soie colorée avec de la mauvéine.
Plus tard, les études sur les colorants chimiques conduisirent également (et de manière accidentelle) au développement de la chimiothérapie moderne.
Analyses chimiques
Une méthode utilisée en routine dans les laboratoires contemporains pour synthétiser la mauvéine consiste à dissoudre une mixture d'aniline, p-toluidine et o-toluidine dans l'acide sulfurique additionné à l'eau, en proportions 1:1:2 environ, puis enfin d'additionner le dichromate de potassium[2]. La structure moléculaire actuelle de la mauvéine a été difficile à prouver, et ne fut connue de façon certaine qu'en 1994, soit plus d'un siècle après sa découverte[3].
C'est en fait un mélange de deux composés arômatiques dont le principal est la mauvéine A, le produit minoritaire étant la mauvéine B, qui présente un groupement méthyle supplémentaire. A est construit à partir de 2 molécules d'aniline, une de p-toluidine et une de o-toluidine, tandis que B comporte une molécule d'aniline, une de p-toluidine et une de o-toluidine. Comme Perkin l'a montré en 1879, la mauvéine B est reliée aux safranines par perte oxydative ou réductrice d'un groupement para-tolyl. En fait, la safranine est un sel de 2,8-diméthyl phenazinium, tandis qu'on suppose la parasafranine produite par Perkin méthylée en position 1 et 8 (ou 2 et 9). En 2007, deux autres composants de la mauvéine ont été identifiés et nommés mauvéine C - qui présente un groupement méthyle en para supplémentaire par rapport à la mauvéine A - et la mauvéine B2 - un isomère de la mauvéine B comportant des groupements méthyle sur différents aryles.
Voir aussi
Liens internes
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Mauveine » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- A Microscale Synthesis of Mauve Scaccia, Rhonda L.; Coughlin, David; Ball, David W. J. Chem. Educ. 1998 75 769 Abstract
- O. Meth-Cohn, M. Smith, "What did W. H. Perkin actually make when he oxidised aniline to obtain mauveine?", J. Chem. Soc. Perkin 1, 1994, 5-7. DOI: 10.1039/P19940000005. This reference is not Open Access.
Catégories :- Colorant organique
- Histoire de la chimie
- Aminobenzène
- Acridine
Wikimedia Foundation. 2010.