- Anhydrique éthanoïque
-
Anhydride acétique
Anhydride acétique 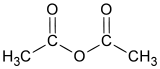
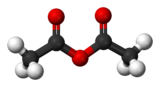
formule semi-développée et représentation 3D de l'anhydride acétique Général Nom IUPAC Anhydride éthanoïque No CAS No EINECS SMILES InChI Apparence liquide incolore, tres mobile, d'odeur âcre.[1] Propriétés chimiques Formule brute C4H6O3 [Isomères] Masse molaire 102,0886 g∙mol-1
C 47,06 %, H 5,92 %, O 47,02 %,Propriétés physiques T° fusion -73 °C[1] T° ébullition 139 °C[1] Solubilité 120 g/L (eau, 20 °C)[2],
soluble dans l'éthanol
l'acétone, le chloroforme,
l'éther diéthylique, l'acétate d'éthyle
et le DMSOMasse volumique (eau = 1) : 1.08[1] T° d’auto-inflammation 316 °C[1] Point d’éclair 49 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 2.7-10.3[1] Pression de vapeur saturante 5 hPa (20 °C) Propriétés optiques Indice de réfraction 1,386 Précautions Directive 67/548/EEC 
CPhrases R : 10, 20/22, 34, Phrases S : (1/2), 26, 36/37/39, 45, Transport 83 1715 NFPA 704 SIMDUT[3] 


SGH[4] 

DangerÉcotoxicologie DL50 1780mg/kg (rat, oral)[2] CL50 1000ppm/4H (rat, inhalation)[2] Composés apparentés Autres composés acide acétique Unités du SI & CNTP, sauf indication contraire. L'anhydride acétique ou anhydride éthanoïque est l'anhydride de l'acide acétique; il est obtenu en liant deux molécules d'acide acétique par condensation avec élimination d'eau (d'où le nom d'anhydride).
L'anhydride acétique dégage des vapeurs irritantes pour les muqueuses oculaires et respiratoires. Ses effets sur le corps humain sont principalement des brûlures cutanées dues à un contact avec la peau et des effets lacrymogènes dus aux gaz volatiles. Il faut donc le manipuler avec du matériel de protection et sous une hotte qui aspire les gaz dangereux. Il s'hydrolyse facilement avec l'humidité de l'air et est inflammable.
Rôle dans la synthèse de l'aspirine
L'anhydride acétique est utilisé pour faire la synthèse de l'acide acétylsalicylique, plus connu sous le nom d'aspirine en réagissant avec l'acide salicylique. Cette réaction est lente et incomplète.
Rôle dans la synthèse du paracétamol
L'acylation du p-aminophénol avec de l'anhydride acétique permet d'obtenir du paracétamol.
Références
- ↑ a , b , c , d , e , f et g ANHYDRIDE ACETIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b et c (en) « Acetic anhydride » sur ChemIDplus, consulté le 5 juin 2009
- ↑ « Anhydride acétique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique corrosif | Anhydride d'acide
Wikimedia Foundation. 2010.


