- Li2CO3
-
Carbonate de lithium
Carbonate de lithium 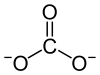
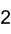
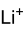

Formule et apparence du carbonate de lithiumGénéral Synonymes Carbonate de dilithium No CAS No EINECS Apparence poudre blanche.[1] Propriétés chimiques Formule brute Li2CO3 Masse molaire 73,891 g∙mol-1
C 16,25 %, Li 18,79 %, O 64,96 %,Propriétés physiques T° fusion 723 °C[1] T° ébullition Se décompose au-dessous du point d'ébullition à 1 310 °C[1] Solubilité 13 g/L dans l'eau froide.
7 g/L eau chaude.
Insol dans l'éthanolMasse volumique 2,11 Précautions SIMDUT[2] Produit non contrôlé Écotoxicologie DL50 rats 710 mg/kg,
souris 531 mg/kgUnités du SI & CNTP, sauf indication contraire. Le carbonate de lithium est un composé chimique de formule Li2CO3. C'est un sel incolore largement utilisé dans le traitement des oxydes métalliques et trouve également des applications en psychiatrie.
Sommaire
Propriétés
Comme les autres carbonates inorganiques, le carbonate de lithium est polymérique. Il est faiblement soluble dans l'eau : 13,3 g/l à température ambiante. Sa solubilité décroît quand la température augmente. Cette propriété est mise à profit pour isoler le lithium des extraits de ses minerais. Sa solubilité décuple sous une faible pression de dioxyde de carbone en raison de la formation du bicarbonate de lithium LiHCO3 :
- Li2CO3 + CO2 + H2O → 2 LiHCO3
Applications
Le carbonate de lithium est un composé industriel important. On l'utilise notamment avec la silice pour former des flux de brasage. Les verres produits avec du carbonate de lithium sont utilisés pour réaliser des fours. Ajouté au trifluorure d'aluminium AlF3, il forme du fluorure de lithium LiF qui améliore les propriétés de l'électrolyte à partir duquel est extrait l'aluminium[3].
Le carbonate de lithium peut également être utilisé comme détecteur de dioxyde de carbone, et intervient dans la fabrication de la plupart des cathodes de batteries lithium-ion, qui sont faites en oxyde de lithium et de cobalt LiCoO2.
En médecine
Article principal : Sels de lithium.Le carbonate de lithium est utilisé pour traiter les états maniaques et le trouble bipolaire. Il retarderait également la progression de la maladie de Charcot, et serait le seul traitement identifié à ce jour capable de produire des effets aussi significatifs.
En pyrotechnie
Le carbonate de lithium est utilisé en pyrotechnie pour colorer les flammes en rouge.
Références
- ↑ a , b et c CARBONATE DE LITHIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Carbonate de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Ulrich Wietelmann, Richard J. Bauer "Lithium and Lithium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH: Weinheim
- Portail de la chimie
Catégories : Composé du lithium | Carbonate
Wikimedia Foundation. 2010.
