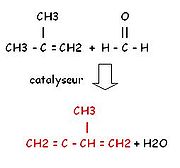
- Isoprene
-
Isoprène
Isoprène 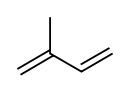
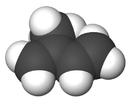
formule développée et modèle 3D de l'isoprèneGénéral Nom IUPAC 2-méthylbuta-1,3-diène No CAS No EINECS PubChem Apparence liquide incolore tres volatil, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C5H8 [Isomères] Masse molaire 68,117 g∙mol-1
C 88,16 %, H 11,84 %,Propriétés physiques T° fusion -146 °C[1] T° ébullition 34 °C[1] Solubilité dans l'eau : nulle[1] Masse volumique (eau = 1) : 0.7[1] T° d’auto-inflammation 220 °C[1] Point d’éclair -54 °C (c.f.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.5 - 8.9[1] Pression de vapeur saturante à 20 °C : 53.2 kPa[1] Précautions Directive 67/548/EEC 
T
F+Phrases R : 12, 45, 52/53, 68, Phrases S : 45, 53, 61, [2] Transport - 1218 NFPA 704 SIMDUT[4] Produit non classifié SGH[5] 

DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[3] Écotoxicologie LogP 2.30[1] Unités du SI & CNTP, sauf indication contraire. L'isoprène est un synonyme commun du composé chimique 2-méthylbuta-1,3-diène. C'est un des quatre isomères du pentadiène qui possèdent des doubles liaisons conjuguées. À température ordinaire, c’est un liquide incolore volatil et odorant, facilement inflammable susceptible de former des mélanges explosifs avec l'air. Il est soluble dans l'alcool, l'acétone, le benzène.
Ce monomère peut polymériser en caoutchouc. En raison de sa grande réactivité, cette polymérisation peut devenir explosive sous l'action de la température. L'isoprène peut devenir un polluant toxique s'il est présent en grandes quantités.
Sommaire
Utilisations
L'isoprène, plus chimiquement actif que le butadiène, est très utilisé dans l'industrie chimique ; obtenu à partir du cracquage de naphta, il sert essentiellement à la production du cis-1,4-polyisoprène, un caoutchouc synthétique utilisé dans la fabrication des pneumatiques de voitures et des gants de chirurgie. Les molécules de caoutchouc sont constituées de chaînes de plusieurs milliers de maillons -CH2 – C(CH3) = CH – CH2 … La masse moléculaire du polymère peut varier de 100 000 à 1 million. Si le caoutchouc naturel est de bonne qualité, il renferme en outre des traces d'autres substances: protéines, acides gras, résines.... Dans d'autres caoutchoucs naturels, on peut trouver son isomère de structure, le trans-1,4-polyisoprene, qui lui confères des propriétés similaires mais néanmoins différentes. Par exemple une résine, la gutta-percha est une polymere naturel tout trans de l'isoprène.
Rôles et effets biologiques
On trouve l'isoprène à l'état naturel dans les plantes,les animaux et le corps humain. La vitesse à laquelle l'isoprène est produit dans le corps humain est d'environ 17 mg / jour pour une personne pesant 70 kg. Il est largement répandu à l'état naturel, en faibles concentrations, ainsi que dans de nombreux aliments.
Il intervient souvent dans la structure de nombreux composés biologiques. À titre d'exemple dans les terpènes comme le carotène (tétraterpène) qui sont dérivés de l'isoprène. Autres dérivés de l'isoprène :
- phytol
- rétinol
- vitamine A
- dolichols
- vitamine E
- squalène
- hème
- lanostérol
Selon le UK Natural Environment Research Council (NERC), de l'isoprène serait émis par les plantes vasculaires en cas de chaleur extrême en transformant l'oxyde d'azote en ozone, ce dernier irritant la gorge.
Obtention
On l'obtient:
- par synthèse à partir d'hydrocarbures.
- par déshydrogénation.
- par dimérisation du propylène suivie d'une isomérisation et d'une déméthylation.
- par action du méthylpropène (isomère du butène) sur le formaldéhyde.
- par craquage des essences légères.
Voir aussi
Notes et références
The Merck Index, Quatorzième édition, ISBN 978-0911910001.
- ↑ a , b , c , d , e , f , g , h , i et j ISOPRENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « isoprène » sur ESIS, consulté le 15 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Isoprène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Lien externe
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique extrêmement inflammable | Cancérogène chimique | Produit chimique dangereux pour l'environnement | Terpène | Diène
Wikimedia Foundation. 2010.