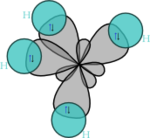
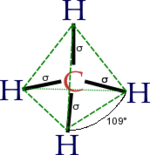
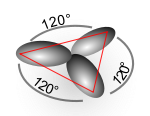
- Hybridation sp3
-
Hybridation (chimie)
 Pour les articles homonymes, voir Hybridation.
Pour les articles homonymes, voir Hybridation.En chimie, l'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de manière à former de nouvelles orbitales qui permettent mieux de décrire qualitativement les liaisons entre atomes. Les orbitales hybrides sont très utiles pour expliquer la forme des orbitales moléculaires des molécules. L'hybridation des orbitales atomiques fait également partie intégrante de la théorie VSEPR (Valence Shell Electronic Pairs Repulsion).
Sommaire
Exemple du méthane
La théorie des orbitales hybrides a été développée par Linus Pauling pour expliquer la géométrie de molécules comme le méthane (CH4). La difficulté de compréhension de cette dernière a pour cause les raisons suivantes.
Il s'agit d'une molécule constituée d'un atome de carbone lié à quatre atomes d'hydrogène. La configuration électronique du carbone dans son état fondamental est 1s² 2s² 2px¹ 2py¹, ou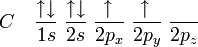
(l'orbitale atomique 1s est plus basse en énergie que l'orbitale 2s, cette dernière étant elle-même plus basse en énergie que les orbitales 2p).
De prime abord, il semblerait que l'atome de carbone ne doive former que deux liaisons covalentes du fait de l'existence de deux orbitales 2p à moitié remplies. Cependant, CH2 ou méthylène n'existe pas en tant que tel mais uniquement comme groupement à l'intérieur de molécules. Ce raisonnement ne permet pas d'expliquer l'existence du méthane.
Par ailleurs un raisonnement impliquant un état excité ne permettrait pas d'expliquer les propriétés du méthane. Si un électron de l'orbitale 2s est excité et occupe l'orbitale 2pz, le carbone peut alors être lié à quatre atomes d'hydrogène (4 orbitales du carbone sont à moitié remplies). Cependant, la forme des orbitales 2s et 2p étant très différentes, le recouvrement avec les orbitales des différents atomes d'hydrogène sera différent, et les quatre liaisons C-H n'auront pas la même énergie ce qui est contraire aux résultats expérimentaux.
L'hybridation
Une manière de répondre au problème de l'existence et de la géométrie de ce type de molécule est l'hybridation des orbitales atomiques. Historiquement, ce concept est apparu pour expliquer les liaisons chimiques dans des systèmes très simples (comme le méthane). Il s'est avéré ensuite que cette théorie est applicable plus largement et elle fait aujourd'hui partie des bases de la compréhension de la chimie organique. Elle est moins facilement applicable aux branches de la chimie pour lesquelles sont mis en jeu des atomes lourds. La théorie de l'hybridation pour la chimie des éléments de transition est plus compliquée et conduit à des résultats nettement moins précis.
Les orbitales (orbitales atomiques, orbitales hybrides ou orbitales moléculaires) constituent un modèle représentant la manière dont les électrons se comportent autour des noyaux atomiques. Dans le cas de l'hybridation, le modèle est basé sur les orbitales atomiques de l'hydrogène. Les orbitales hybrides sont des mélanges de ces orbitales atomiques où elles se recouvrent en différentes proportions. Les orbitales atomiques utilisées comme base sont celles de l'hydrogène car il s'agit du seul cas pour lesquel il est possible de résoudre exactement l'équation de Schrödinger. Les orbitales obtenues sont alors légèrement déformées dans les atomes plus lourds comme le carbone, l'azote et l'oxygène.
La première étape dans la construction des orbitales hybrides est l'excitation d'un (ou plusieurs) électron(s). Pour simplifier, la suite du texte traite plus particulièrement de l'exemple de la molécule de méthane. Le proton constituant le noyau d'un atome d'hydrogène attire l'un des électrons de valence du carbone. Celui-ci occupe alors un état excité, avec un électron 2s occupant une orbitale 2p. En conséquence, l'influence du noyau de l'atome de carbone sur les électrons de valence augmente du fait de l'augmentation de la charge effective (charge effectivement ressentie par les électrons : elle est égale à la charge du noyau diminuée de l'écrantage causé par les autres électrons). La combinaison de ces forces (attraction par le noyau d'hydrogène et modification de l'attraction par le noyau de carbone) conduit à de nouvelles fonctions mathématiques, les orbitales hybrides. Dans le cas de l'atome de carbone lié à quatre atomes d'hydrogène, il se crée quatre nouvelles orbitales : l'orbitale 2s se mélange avec les trois orbitales 2p pour former quatre orbitales hybrides sp3 :
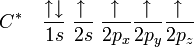 devient
devient 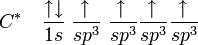
Dans CH4, ces quatre orbitales sp3 se recouvrent avec les quatre orbitales 1s des quatre atomes d'hydrogène ce qui conduit à la formation de quatre liaisons sigma. Ces quatre liaisons ont la même longueur et la même énergie, ce qui est conforme aux résultats expérimentaux.
La structure des autres molécules organiques s'explique de manière similaire. Par exemple dans l'éthylène, les orbitales atomiques du carbone se mélangent pour former des orbitales hybrides sp2, et le recouvrement entre les atomes de carbone et avec ceux d'hydrogène conduit à la formation de quatre liaisons C-H de type sigma et à une double liaison C-C (liaison de type σ -recouvrement axial- superposée par une liaison de type π -recouvrement lateral-.
La proportion de caractère p n'est pas restreinte à des valeurs entières, et il existe par exemple des orbitales hybrides sp2.5. Dans ce cas, la géométrie est déformée par rapport aux orbitales hybrides "idéales". D'après la règle de Bent, le caractère p d'une liaison est d'autant plus grand qu'elle est dirigée vers un élément plus électronégatif.
Forme des molécules
Alliée à la théorie VSEPR, l'hybridation des orbitales permet d'expliquer qualitativement la géométrie des molécules :
Orbitales hybrides Géométrie type de molécule sp linéaire AX2 (ex : BeCl2) sp2 trigonale AX3 (ex : BCl3, graphite) sp3 tétraèdrique AX4 (ex : CH4) sp3d bipyramide trigonale AX5 (ex : PCl5) sp3d2 octaèdrique AX6 (ex : SF6); AX5E (ex:ClF5) dsp2 plan-carré (ex : complexe du cuivre) Ces exemples sont valables lorsque l'atome central ne porte pas en plus une paire d'électrons. Si tel est le cas, celle-ci est décompté avec Xi mais les angles de liaisons sont différents. C'est le cas par exemple pour la molécule d'eau H2O : la géométrie est bien tétraèdrique (en prenant en compte les doublets électroniques), mais le tétraèdre est déformé (angle HOH de 104,5 degrés).
De telles déformations (de quelques degrés seulement) sont anecdotiques et la forme générale des polyèdres réguliers peut être retenue.Au delà des systèmes de type AX4, c'est à dire au delà de l'hybridation sp3, on voit apparaître des orbitales d dont la participation à la liaison est très controversée, et pour le moins délicate à expliquer. En fait, on peut très bien construire les orbitales moléculaires d'une bipyramide trigonale sans avoir recours aux orbitales d. Mieux, les méthodes quantiques conduisent à PCl5 en bipyramide trigonale alors même qu'aucune orbitale d ne figure dans le calcul.
Les qualifier de parfaitement inutiles est sans doute un peu exagéré, mais ces hybridations sp3d ou sp3d2 et dsp2 ne peuvent avoir en tous cas qu'un rôle très marginal dans notre compréhension de la chimie : ces systèmes sont bien mieux décris par la théorie des Orbitales Moléculaires délocalisées.Références
- (en) L. Pauling, J. Am. Chem. Soc. 53 (1931), 1367
- (en) L. Pauling, The Nature of the Chemical Bond, Cornell University Press (ISBN 0-8014-0333-2)
- (en) Clayden, Greeves, Warren, Wothers. Organic Chemistry. Oxford University Press (2001), ISBN 0-19-850346-6.
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Orbital hybridisation ».
- (en) H. A. Bent, Chem. Rev.; 68 (1968), 587-648.
Voir aussi
- Portail de la chimie
Catégorie : Chimie quantique
Wikimedia Foundation. 2010.