- Hsp70
-
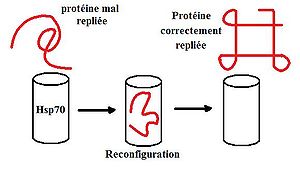 Explication du fonctionnement d'Hsp70. La protéine mal conformé pénètre dans Hsp70 schématisé sous forme d'un cylindre. Celui-ci va replier la protéine qui ressortira avec sa conformation définitive.
Explication du fonctionnement d'Hsp70. La protéine mal conformé pénètre dans Hsp70 schématisé sous forme d'un cylindre. Celui-ci va replier la protéine qui ressortira avec sa conformation définitive.
HSP signifie protéines de choc thermique (heat shock proteins). Ce sont en fait des protéines chaperonnes, de classe 1. En effet, elles sont garantes de la bonne conformation des protéines de la cellule, et les aide à se protéger des stress externes[1],[2].
Sommaire
Découverte
Les membres de la famille Hsp70 sont fortement régulatrices du stress dû à la chaleur et les produits chimiques toxiques, en particulier les métaux lourds comme l'arsenic, le cadmium, cuivre, mercure, etc. Hsp70 a été initialement découverte par Ritossa FM dans les années 1960 quand un travailleur de laboratoire a accidentellement augmenté la température d'incubation d'une culture de Drosophilas (mouches des fruits). Lors de l'examen des chromosomes, Ritossa trouvé une augmentation de la transcription des gènes d'une protéine inconnue[3],[4]. Cela fut plus tard décrit comme la «Heat Shock Response» et les protéines ont été appelées « Heat Shock Proteins » (Hsps).
Structure
Toutes les protéines Hsp70 ont trois grands domaines fonctionnels.
- Un domaine N-terminal du domaine ATPase lie l'ATP (adénosine triphosphate) et hydrolyse l'ADP (adénosine diphosphate). L'échange de l'ATP réalise des changements conformationnels dans les deux autres domaines.
- Un domaine de fixation du substrat avec une affinité pour les molécules neutres, d'acides aminés hydrophobes résidus. Le domaine est suffisamment long pour interagir avec des peptides jusqu'à sept résidus de longueur.
- Un domaine C-terminal riche en structure en hélice alpha, qui agit comme un « couvercle » pour le domaine de fixation du substrat. Quand une protéine Hsp70 est liée à l'ATP, le couvercle est ouvert et relâche relativement rapidement le peptide. Lorsque les protéines Hsp70 sont liées à l'ADP, le couvercle est fermé, et les peptides sont étroitement liés au domaine de fixation du substrat.
Fonction et régulation
La chaleur est un des plus grands ennemis des protéines puisque cela modifie le reploiement et par conséquent, altère la fonction de la protéine. Dès lors, l'évolution a mis en place des systèmes permettant d'éviter cette dénaturation par la chaleur pour ne pas avoir à remplacer trop souvent les protéines dénaturées (le recyclage des protéines est appelé le « turn-over »). Le rôle des HSP est de garantir la bonne conformation des protéines dans la cellule.
Les HSP se distinguent par le fait qu'elles possèdent plus d'acides aminés capables d'établir de fortes interactions entre eux que les protéines « normales », c'est-à-dire, non-HSP. Par conséquent, les HSP sont donc moins « flexibles » et moins sensibles à la chaleur.
Concrètement, une HSP s'approche d'une protéine. Selon que la conformation de la protéines est bonne ou mauvaise, elle permettra ou non l'association de la HSP ou sera dirigée vers le protéasome pour être dégradée. Si la HSP s'est associée, cette dernière va servir de « squelette » à la protéine ce qui lui évite de se faire déformer (dénaturer) par la chaleur. Plus tard, les deux protéines se séparent et continuent leur vie dans la cellule.
Le terme « HSP » regroupe en fait toute une famille de protéines, chacune ayant un partenaire protéique spécifique. Certaines HSP sont exprimées (synthétisées) tout le temps alors que d'autres sont exprimées suite à une brusque augmentation de la température.
Cancer
HSP 70 est surexprimé dans les mélanomes malins et sousexprimé dans les cellules rénales cancéreuses.
Membre de la famille
Les procaryotes expriment trois protéines Hsp70: DnaK, HscA (Hsc66), et HscC (Hsc62)[5].
Les organismes eucaryotes expriment plusieurs protéines Hsp70 légèrement différentes (car très conservées au cours de l'évolution étant donné qu'elles sont essentielles). Toutes partagent la même structure de domaine, mais chacune a un modèle unique d'expression.
- Hsc70 (Hsp73/HSPA8) est constitutivement dite protéine chaperon. Elle représente généralement un à trois pour cent du total des protéines cellulaires.
- Hsp72 (HSPA1A) est une protéine induite par le stress. Des concentrations élevés peuvent être produites par les cellules en réponse à une hyperthermie, un stress oxydatif, et des changements de pH.
- Binding immunoglobulin protein (BIP ou Grp78) est une protéine localisée au niveau du réticulum endoplasmique. Elle est impliquée dans le repliement des protéines, et sa concentration et fonction varie en réponse au stress ou à la famine.
- mtHsp70 ou Grp75 est la Hsp70 mitochondriale.
Ce qui suit est une liste des gènes d'Hsp70 de l'homme et de leurs protéines correspondantes[1]:
gèn" proteine synonymes localisation
cellulaireHSPA1A Hsp70-1a HSP70-1, Hsp72 Noyau/Cyto HSPA1B Hsp70-1b HSP70-2 Nuc/Cyto HSPA1L Hsp70-1L ? HSPA2 Hsp70-2 ? HSPA4 Hsp70-4 ? HSPA4L Hsp70-4L ? HSPA5 Hsp70-5 BiP/Grp78 ER HSPA6 Hsp70-6 ? HSPA7 Hsp70-7 ? HSPA8 Hsp70-8 Hsc70 Nuc/Cyto HSPA9 Hsp70-9 Grp75/mtHsp70 Mito HSPA12A Hsp70-12a ? HSPA14 Hsp70-14 ? Notes et références
- Tavaria M, Gabriele T, Kola I, Anderson RL, « A hitchhiker's guide to the human Hsp70 family », dans Cell Stress Chaperones, vol. 1, no 1, avril 1996, p. 23–8 [lien PMID]
- Morano KA, « New tricks for an old dog: the evolving world of Hsp70 », dans Ann. N. Y. Acad. Sci., vol. 1113, octobre 2007, p. 1–14 [lien PMID, lien DOI]
- Ritossa F, « A new puffing pattern induced by temperature shock and DNP in drosophila », dans Cellular and Molecular Life Sciences (CMLS), vol. 18, no 12, 1962, p. 571-573 [lien DOI]
- Ritossa F, « Discovery of the heat shock response », dans Cell Stress Chaperones, vol. 1, no 2, juin 1996, p. 97–8 [lien PMID]
- Yoshimune K, Yoshimura T, Nakayama T, Nishino T, Esaki N, « Hsc62, Hsc56, and GrpE, the third Hsp70 chaperone system of Escherichia coli », dans Biochem. Biophys. Res. Commun., vol. 293, no 5, mai 2002, p. 1389–95 [lien PMID, lien DOI]
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.
