- Hsp60
-
Les Heat shock proteins sont généralement responsables de la prévention des dommages à des protéines en réponse à des niveaux élevés de température. Les protéines de choc thermique sont classées en six grandes familles en fonction de leur masse moléculaire : petite Hsps, Hsp40, Hsp60, Hsp70, Hsp90, et Hsp110.
Découverte
L'HSP60 de mammifères a été signalée pour la première fois comme une protéine mitochondriale P1. Son rôle dans le repliement des protéines a été démontré en 1989<[1] par Art Horwich et Ulrich Hartl qui recevront le Prix Albert Lasker pour la recherche médicale fondamentale en 2011 pour leurs travaux sur ce thème. Elle a ensuite été clonée et séquencée par Radhey Gupta et collaborateurs[2]. La séquence d'acides aminés a montré une forte homologie avec GroEL, déjà suspecté dès 1988[3]. On a d'abord cru que HSP60 fonctionnait seulement dans les mitochondries et qu'il n'y avait pas d'équivalent en protéines se trouvant dans le cytoplasme. Les découvertes récentes ont discrédité cette première approche et ont suggéré qu'il existe une différence notable entre HSP60 des mitochondries et Hsp60 du cytoplasme[4]. Une structure similaire existe dans le chloroplaste de certaines plantes.
Structure
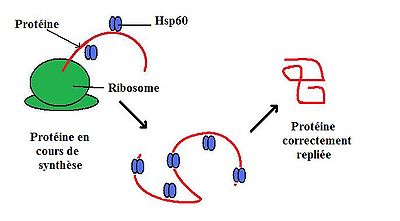
Dans les conditions physiologiques normales, HSP60 fait 60 kiloDalton et est composée d'oligomères et de monomères qui forment un complexe organisé en deux anneaux empilés[5]. Cette double structure en anneau forme une grande cavité centrale dans laquelle s'est déroulée la protéine et où elle est liée par des interactions hydrophobes[6]. Cette structure est généralement en équilibre avec chacun de ses composants individuels: les monomères, heptamers, et tetradeceamers[7]. Des études ont commencé à suggérer que, en plus de son emplacement typique dans les mitochondries, HSP60 peut également être trouvé dans le cytoplasme sous conditions physiologiques normales[4].
Notes
- Cheng MY, Hartl FU, Martin J, Pollock RA, Kalousek F, Neupert W, Hallberg EM, Hallberg RL, Horwich AL, Mitochondrial heat-shock protein hsp60 is essential for assembly of proteins imported into yeast mitochondria, Nature, 1989;337:620–625
- Gupta, RS. Evolution of chaperonin families (HSP60, HSP10, and TCP-1) of proteins and the origin of eukaryotic cells. Molecular Microbiology 15, 1-11, 1995.
- McMullin TW, Hallberg RL, A highly evolutionarily conserved mitochondrial protein is structurally related to the protein encoded by the Escherichia coli groEL gene, Mol Cell Biol, 1988;8:371–380
- Itoh, H; Komatsuda, A; Ohtani, H; Wakui, H; Imai, H; Sawada, K, Otaka, M; Ogura M; Suzuki, A; Hamada, F. Mammalian HSP60 is quickly sorted into the mitochondria under conditions of dehydration. Eur. J. Biochem. 269, 5931-5938, 2002.
- Cheng, MY; Hartl, FU; Horwich, AL. The mitochondrial chaperonin HSP60 is required for its own assembly. Nature 348: 455- 458; 1990.
- Fenton, WA. Residues in chaperonin GroEL required for polypeptide binding and release. Nature 371, 614-619; 1994.
- Habich, C; Burkart, V. Heat shock protein 60: regulatory role on innate immune cells. Cell Mol. Life Sci. 64, 742-751, 2007.
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.