- Glioblastome multiforme
-
 Pour les articles homonymes, voir GBM.
Pour les articles homonymes, voir GBM.Glioblastome multiforme
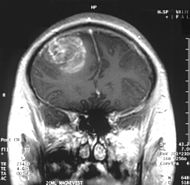
Classification et ressources externesImage IRM d'un glioblastome de grade IV. CIM-10 C71. CIM-9 191 ICD-O: M9440/3 OMIM 137800 DiseasesDB 29448 eMedicine neuro/147 med/2692 MeSH D005909 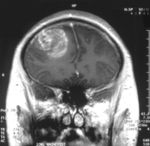 Image 1a. IRM cérébrale avec injection de produit de contraste : Coupe frontale, glioblastome multiforme chez un enfant de 15 ans.
Image 1a. IRM cérébrale avec injection de produit de contraste : Coupe frontale, glioblastome multiforme chez un enfant de 15 ans.
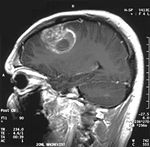 IRM cérébrale avec injection de produit de contraste : Coupe sagittale, glioblastome multiforme chez un enfant de 15 ans.
IRM cérébrale avec injection de produit de contraste : Coupe sagittale, glioblastome multiforme chez un enfant de 15 ans.
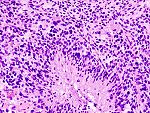 Aspect d'un glioblastome sur une lame d'histologie.
Aspect d'un glioblastome sur une lame d'histologie.
Le glioblastome multiforme (GBM) ou glioblastome, également connu sous le nom d'astrocytome de grade 4, est la tumeur primitive du cerveau la plus fréquente et la plus agressive.
Le traitement peut comprendre de la chimiothérapie, de la radiothérapie et de la chirurgie. Ces mesures sont considérées comme palliatives, c'est-à-dire qu'elles ne permettent pas la guérison. L'espérance de vie à cinq ans de cette maladie a peu évolué ces trente dernières années, et ne dépasse pas les dix pour cent. Même avec une résection chirurgicale complète de la tumeur, combinée aux meilleurs traitements disponibles, le taux de survie au GBM reste très faible.
Sommaire
Épidémiologie
Elle représente 70% des tumeurs primitives malignes du cerveau[1] et 20% de toutes les tumeurs intra-crâniennes. Le GBM reste rare et ne représente que 2 ou 3 cas pour 100 000 personnes en Europe et en Amérique du Nord.
Causes
Presque tous les cas de GBM sont sporadiques, sans prédisposition familiale, même si des anomalies chromosomiques comme la mutation des gènes PTEN, MDM2, et p53 sont fréquemment rencontrées dans ces tumeurs. Des signaux anormaux des facteurs de croissance associés aux gènes EGFR, et PDGF sont également perçus. Une délétion du gène NFKBIA, codant pour un inhibiteur du système EGFR, entraîne une surexpression de ce dernier et serait une voie d'activation des glioblastomes[2].
Pathogenèse
Les glioblastomes multiformes sont caractérisés par la présence de petites zones de tissu nécrosé entourées de cellules hautement anaplasiques. Cette caractéristique différencie la tumeur des astrocytomes de Grade 3, qui ne possèdent pas ces zones de tissu nécrosé. Bien que le glioblastome multiforme puisse être issu d'astrocytomes de grades inférieurs, des autopsies post-mortem ont révélé que la plupart des glioblastomes multiformes ne sont pas causés par des lésions cérébrales antérieures.
Contrairement aux oligodendrogliomes, les glioblastomes multiformes peuvent se former dans la matière grise ou la matière blanche du cerveau, mais la plupart des GBM se forment au plus profond de la matière blanche et infiltrent rapidement le cerveau, devenant parfois très gros avant de donner des symptômes. La tumeur peut s'étendre à la paroi méningée ou à la paroi ventriculaire, entrainant une haute teneur en protéines du liquide céphalo-rachidien (LCR) (> 100 mg/dL) appelée hyperprotéinorachie, et occasionnellement une pléocytose de 10 à 100 cellules, en majorité des lymphocytes. Les cellules malignes présentes dans le LCR peuvent s'étendre à la moelle épinière ou causer une gliomatose méningée. Cependant, les métastases du GBM au-delà du système nerveux central sont extrêmement rares. Environ 50% des GBM occupent plus d'un lobe d'un hémisphère ou sont bilatéraux. Les tumeurs de ce type naissent généralement dans le cortex, et peuvent traverser le corps calleux, produisant un gliome "papillon" (bilatéral).
La tumeur peut prendre des apparences variées, en fonction de l'étendue de l'hémorragie ou de la nécrose, ou de son âge. Une scanographie (CT scan) montre généralement une masse non homogène avec un centre hypodense étendu en un anneau de taille variable entouré d'œdème. Il existe un effet de masse avec un déplacement possible du ventricule latéral et du troisième ventricule.
Symptômes
Bien que les symptômes communs de la maladie incluent des crises d'épilepsie, des nausées et des vomissements, des maux de tête, et une hémiparésie, le symptôme le plus fréquent est une perte progressive de la mémoire, une dégradation de la personnalité, ou un déficit neurologique dus à un endommagement des lobes frontal et temporal. Le type de symptômes dépend essentiellement de l'emplacement de la tumeur, plus que de ses propriétés pathologiques. La tumeur peut devenir symptomatique rapidement, mais il arrive qu'elle reste asymptomatique malgré une taille énorme.
Diagnostic
Le diagnostic d'un GBM suspecté lors d'un scanner ou une IRM repose sur une biopsie stéréotaxique ou une craniotomie, qui permet, par la même occasion, de retirer autant de tumeur que possible. Bien que la totalité de la tumeur ne puisse théoriquement pas être retirée, en raison de sa multicentricité et de son caractère diffus, une résection partielle peut tout de même prolonger légèrement l'espérance de survie.
Traitement
Le traitement des tumeurs primaires du cerveau et des métastases cérébrales consiste en des thérapies à la fois symptomatiques et palliatives.
Traitement symptomatique
Le traitement symptomatique consiste à soulager les symptômes et améliorer les fonctions neurologiques du patient. Les principaux médicaments utilisés sont les anticonvulsivants et les corticostéroides.
- Les anticonvulsivants sont administrés aux 25% des patients présentant une épilepsie. Des études ont montré l'inefficacité des anticonvulsivants prophylactiques. Les patients recevant de la phénytoïne parallèlement aux rayons peuvent développer de sérieuses réactions cutanées comme l'érythème multiforme et le syndrome de Stevens-Johnson.
- Les corticostéroides, en général la dexaméthasone dont on administre 4 à 10 mg toutes les 4 à 6 h, peuvent réduire l'œdème péritumoral (par un réarrangement de la barrière hématoméningée), diminuant l'effet de masse et réduisant la pression intra-crânienne, entraînant une diminution des maux de tête et de la somnolence.
Traitement antitumoral
Une résection maximale de la tumeur (debulking) est généralement effectuée associée à un protocole de radiothérapie et de chimiothérapie. Une irradiation crânienne totale (4500 cGy) avec une dose augmentée (1500 à 2000 cGy) à l'emplacement de la tumeur, peut augmenter de 5 mois l'espérance de survie [voir ci-dessous]. L'addition de carmustine (utilisée en chimiothérapie) seule augmente légèrement l'espérance de survie. La plupart des oncologues préfèrent une chimiothérapie combinée associant la procarbazine, la lomustine, et la vincristine (régime PCV). Une autre combinaison inclut la carboplatine et la cisplatine. Leur efficacité est limitée et leur toxicité, en particulier avec le régime PCV, est considérable. En dépit de précédentes études suggérant la supériorité du régime PCV sur la Carmustine, on dispose maintenant de données prouvant que le PCV n'est nullement plus efficace que la Carmustine, que ce soit sur des patients atteints de glioblastome ou d'astrocytome anaplastique. La Brachythérapie (implantation de grains ou d'aiguilles radioactives) et la radiothérapie ciblée à hautes doses (radiochirurgie stéréotactique) n'ont montré aucune augmentation de l'espérance de survie.
Lors d'un important essai de phase III, des implants imprégnés de BiCNU (appellation commerciale Gliadel Wafers) mis en place au moment de la résection primaire ont augmenté la survie moyenne à 13,9 mois, comparé aux 11,6 mois des implants placebo (P = .03) pour les patients chez qui on venait de diagnostiquer un gliome malin. En dépit du traitement initial, pratiquement tous les gliomes malins récidivent. Lors d'une rechute, les patients peuvent bénéficier d'une re-résection, de techniques de radiothérapie focale (comme la radiochirurgie), et de différents agents chimiothérapeutiques. Selon l'agent chimiothérapeutique utilisé lors du traitement initial, la temozolomide, la procarbazine, ou la nitrosourea peuvent représenter un choix raisonnable en cas de récidive. Des essais cliniques employant des inhibiteurs des signaux de transduction et des récepteurs des facteurs de croissance épidermiques, ou des agents antiangiogènes peuvent également être effectués lors d'une récidive de la tumeur.
Dans un article récent[3], la chloroquine, médicament antimalarien, a montré une augmentation de la survie à moyen terme lorsqu'elle est combinée à une thérapie conventionnelle (dans ce cas, ablation chirurgicale et traitement à la Carmustine). Des recherches plus poussées dans ce domaine seraient utiles.
Une autre technique thérapeutique[réf. nécessaire] possible est d'utiliser des virus pour attaquer le cancer.
Traitement palliatif
Un traitement palliatif est fréquemment proposé pour améliorer la qualité de vie du patient dans les dernières semaines.
Récidives
La résurgence de la tumeur après traitement médicamenteux ou chirurgical est quasiment inévitable, en général à moins de 2 cm du site d'origine, et dans 10% des cas les lésions peuvent apparaître en dehors du site d'origine. La ré-opération ou brachytherapy est tenté à nouveau avec des résultats incertains. La thérapie la plus agressive, une seconde intervention et chimiothérapie, est généralement utilisée sur les patients de moins de 40 ans dont la précédente opération remonte à plusieurs mois. Si le régime PCV n'a pas été utilisé, il peut être essayé. Un nouvel agent, le temozolomide peut être utilisé. Cependant, ces traitements augmentent les intervalles sans aucun symptômes au lieu de prolonger la survie.
Pronostic
La survie médiane sans traitement à partir du diagnostic est de trois mois. Un age supérieur à 60 ans, une altération de l'état général, une exérèse incomplète sont des facteurs de mauvais pronostic. Le décès est habituellement dû à un œdème cérébral qui entraine une augmentation de la pression intra-crânienne puis une altération de la vigilance.
Avec le traitement standard, c'est-à-dire chirurgie puis radio-chimiothérapie concomitante et chimiothérapie adjuvante avec le temozolomide, la survie médiane est approximativement de 14 mois[4].
Références
- Wen PY, Kesari S, Malignant gliomas in adults, N Engl J Med, 2008;359:492-507
- Bredel M, Scholtens DM, Yadav AK,NFKBIA Deletion in Glioblastomas, N Eng J Med, 2011;364:627-637
- {http://www.ncbi.nlm.nih.gov/pubmed/15727424?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=2&log$=relatedarticles&logdbfrom=pubmed}
- Stupp R, Mason W, van den Bent M, Weller M, Fisher B, Taphoorn M, Belanger K, Brandes A, Marosi C, Bogdahn U, Curschmann J, Janzer R, Ludwin S, Gorlia T, Allgeier A, Lacombe D, Cairncross J, Eisenhauer E, Mirimanoff R, « Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. », dans N Engl J Med, vol. 352, no 10, 2005, p. 987-96
Lectures connexes
Liens externes
Catégories :- Maladie de l'encéphale
- Maladie tumorale du système nerveux
Wikimedia Foundation. 2010.