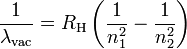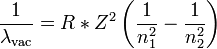- Formule de Rydberg-Ritz
-
Formule de Rydberg
La formule de Rydberg (ou de Rydberg-Ritz) est utilisée en physique atomique pour déterminer le spectre complet de la lumière émise par l'hydrogène ; elle fut plus tard généralisée à tout élément chimique.
Le spectre est l'ensemble des longueurs d'onde des photons émis lors des sauts des électrons entre des niveaux d'énergie discrets, "couches" autour de l'atome d'un élément chimique. Cette découverte a plus tard suscité la création de la physique quantique.
Cette formule a été découverte par les physiciens suédois Johannes Rydberg et suisse Walther Ritz puis présentée le 5 novembre 1888.
Formule de Rydberg pour l'hydrogène
Où
- λvac est la longueur d'onde de la lumière dans le vide.
- RH est la constante de Rydberg de l'hydrogène.
- n1 et n2 sont des entiers tels que n1 < n2.
En fixant n1 = 1 et avec n2 allant de 2 à l'infini, les raies spectrales connues sous le nom de série de Lyman convergeant vers 91 nm sont obtenues par la même méthode :
n1 n2 Nom Converge vers 1 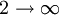
Série de Lyman 91 nm 2 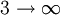
Série de Balmer 365 nm 3 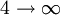
Série de Paschen 821 nm 4 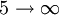
Série de Brackett 1459 nm 5 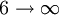
Série de Pfund 2280 nm 6 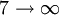
Série de Humphreys 3283 nm La série de Lyman est dans le domaine de l'ultraviolet tandis que celle de Balmer est dans le domaine visible et que les séries de Paschen, Brackett, Pfund, et Humphreys sont dans le domaine de l'infrarouge.
Généralisation aux hydrogénoïdes
La formule ci-dessus peut être généralisée à tout ion hydrogénoïde, c'est-à-dire ne possédant qu'un unique électron. Les ions He+, Li2+, Be3+ en sont des exemples.
où
- λvac est la longueur d'onde de la lumière dans le vide,
- R est la constante de Rydberg de l'élément, dépendant notamment du numéro atomique Z,
- n1 et n2 sont des entiers tels que n1 < n2,
- Z est le numéro atomique, i.e. le nombre de protons dans le noyau atomique de cet élément.
Note
Il apparaît que cette formule de Rydberg est celle d'une famille d'hyperboles, n1 et n2 définissant les positions respectives des sommets et des foyers. Ces hyperboles sont des franges d'interférences produites entre les ondes émises par le proton et par l'électron. Comme l'atome d'hydrogène n'a qu'un proton et qu'un électron, la représentation graphique des interférences est simple et claire; pour les autres atomes, à l'exception des hydrogénoïdes, le modèle devient plus brouillé.
- Portail de la physique
Catégorie : Physique atomique
Wikimedia Foundation. 2010.