- Forces de london
-
Forces de London
Les forces de dispersion de London sont des forces faibles intermoléculaires créées par des dipôles induits. Elles représentent en général la composante la plus importante des forces de Van der Waals. Elles tirent leur nom du physicien germano-américain Fritz London qui formula mathématiquement ces forces pour deux molécules identiques en 1937.
Les forces de London existent du fait que la densité électronique des molécules est probabiliste : il y a une forte chance à tout moment pour que celle-ci ne soit pas équitablement répartie à travers la molécule, ce qui crée un léger moment dipolaire. Les moments dipolaires vont varier très rapidement au cours du temps. Ainsi à chaque distribution inhomogène se crée un moment dipolaire induit qui peut interagir avec les moments dipolaires induits des molécules voisines et une force s'exerce entre les molécules. Naturellement, ces dipôles induits peuvent également réagir avec un dipôle permanent (molécule polaire) mais les forces qui en résultent prennent alors le nom de forces de Debye. L'effet apparaît également dans les molécules polaires, mais c'est alors les forces de Keesom qui prennent le dessus le plus souvent et les forces de London jouent alors un rôle souvent minime dans les interactions entre dipôles permanents.
De manière générale, pour des molécules polaires, les forces de London sont très faibles devant les autres forces intermoléculaires, par exemple les interactions ioniques ou les liaisons hydrogène ou les forces de Keesom entre dipôles permanents. Néanmoins, pour des molécules neutres (comme l'hélium), les forces de London sont la seule force attractive intermoléculaire à grande distance. Elles sont aussi prépondérantes dans les forces d'attraction entre molécules non polaires comme le diazote ou le méthane ou même les gaz rares. Sans l'effet des forces de London, il serait impossible de liquéfier ces gaz.
Formulation
L'énergie des forces de dispersion de London Elondon entre deux molécules de polarisabilité différentes peuvent se poser sous la forme :
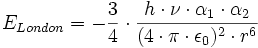
avec:
- h constante de Plank (6,626.10-34 J.s)
- ν la fréquence électronique d'absorption (Hz)
- α la polarisabilité électrique (C².m².J-1)
- ε0 la permittivité diélectrique du vide (8,854.10-12 C².J-1.m-1)
- r la distance moyenne entre les molécules (m)
L'expression des forces s'obtient en dérivant l'énergie par rapport à la distance moyenne entre les molécules. En simplifiant, la force s'écrit sous la forme :
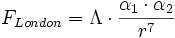 avec Λ constante.
avec Λ constante.Les forces de London croissent avec la taille des molécules mises en jeu, car l'augmentation de la taille va avec la dispersion du nuage électronique et donc une augmentation du moment dipolaire induit. Cet effet peut se constater sur les dihalogènes ( F2, Cl2, Br2, I2) : tandis que le difluor et le dichlore sont à l'état de gaz dans les conditions de pression et de température normale, le dibrome est liquide et le diiode solide.
Articles connexes
- Électronégativité
- Dipôle électrostatique
- Forces de Van der Waals
- Liaison hydrogène
- Forces de Keesom
- Forces de Debye
- Portail de la physique
- Portail de la chimie
Catégories : Liaison chimique | Physique quantique | Électromagnétisme
Wikimedia Foundation. 2010.
