- Forces De Keesom
-
Forces de Keesom
Les forces de Keesom résultent d'une interaction intermoléculaire entre dipôles permanents. Elles ont été nommées en l'honneur de Willem Hendrik Keesom qui fut le premier à fournir leur formulation mathématique en 1912.
Les forces de Keesom sont principalement liées à l'électronégativité. Elles apparaissent entre au moins deux molécules polaires (dipôles dits permanents), d'où leur ancien nom d'interaction « dipôle-dipôle ». Les forces de Keesom, tout comme les forces de Debye (dipôle permanent / dipôle induit) et de London (dipôle induit / dipôle induit) ne sont qu'une composante des forces de Van der Waals. En général les forces de Keesom représentent la part la plus importante de ces interactions, mais ce n'est pas toujours vrai.
Les forces de Keesom sont directionnelles. On peut rattacher les interactions de Keesom aux interactions ioniques, mais comme les forces de Keesom ne font intervenir que partiellement les charges, elles sont moins fortes.
Les forces de Keesom permettent souvent d'expliquer l'évolution de certaines propriétés physiques en fonction du moment dipolaire dans des molécules de structure proche. En effet, les forces de Keesom jouent pour une grande part dans l'agencement des molécules les unes par rapport aux autres. Pour vaincre les forces de Keesom qui existent entre molécules polaires, il est nécessaire d'apporter une énergie plus grande que dans le cas des molécules de même masse molaire mais apolaires. Ainsi les liquides à molécules polaires ont souvent des températures d'ébullition plus élevées que ceux à molécules apolaires de même masse molaire.
Formulation
On étudie l'interaction entre deux dipôles de moments dipolaires permanents respectifs μ1 et μ2 éloignés d'une distance moyenne r . En l'absence d'autres forces extérieures, les dipôles s'alignent pour minimiser l'énergie, comme le feraient deux aimants. Néanmoins, en raison de l'agitation thermique, ils ont également tendance à se désaligner. Il existe donc un degré de liberté angulaire à prendre en compte à l'aide de la statistique de Boltzmann. L'énergie potentielle E qui s'ensuit a la forme :
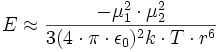
Avec :
- ε0, permittivité relative ou constante diélectrique du vide (8,854 10-12 C2J -1m -1)
- k, constante de Boltzmann (1,381 10-23 J K -1)
- T, température (K)
En calculant la dérivée de l'énergie par rapport à la distance moyenne r, on peut remonter à l'expression de la force de Keesom :
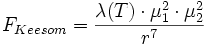
- où λ (T), est une fonction de la température.
On remarque que les forces de Keesom s'atténuent très vite avec la distance (inversement proportionnelles à la puissance 7 de la distance). Notons en outre que les forces de Keesom sont liées à l'arrangement moléculaire et donc à la température. Quand cette dernière augmente, les forces de Keesom faiblissent.
L'énergie de ce genre de liaison varie entre 0,5 et 3 kJ/mol.
Voir aussi
- Électronégativité
- Dipôle électrostatique
- Forces de Van der Waals
- Liaison hydrogène
- Forces de London
- Forces de Debye
- Portail de la physique
- Portail de la chimie
Catégories : Liaison chimique | Physique quantique | Électromagnétisme
Wikimedia Foundation. 2010.
