- E459
-
Cyclodextrine
Les cyclodextrines ou cycloamyloses sont des molécules-cages d’origine naturelle qui permettent d’encapsuler diverses molécules[1]. Elles ont aujourd’hui d’innombrables applications industrielles, et on les retrouve dans une multitude de produits courants. Elles sont aussi l’objet de très nombreuses recherches scientifiques.
Sommaire
Généralités
Description
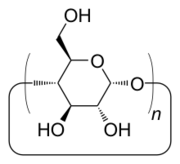
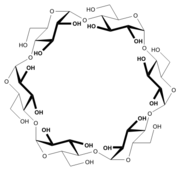
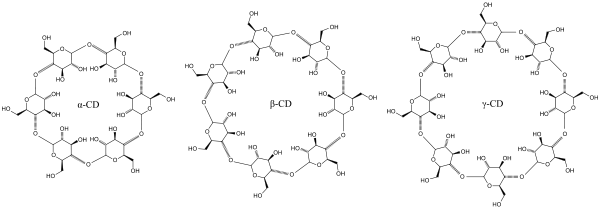
Les cyclodextrines sont une famille d'oligosaccharides cycliques composés de sous-unités glucopyranose liées en α-(1,4). Ces produits naturels résultant de la dégradation de l'amidon par la bactérie Bacillus macerans, ont été découverts en 1891 par Villiers. Trois familles sont principalement utilisées ou étudiées les α-, β- et γ-cyclodextrines formées de 6, 7 ou 8 sous-unités (des familles de plusieurs dizaines de sous-unités ont été synthétisées dans des buts de recherche). Ces dernières années ont vu l’explosion du nombre de recherches concernant cette famille de composés chimiques.
La formule brute de la β-cyclodextrine est C42H70O35, sa masse molaire est donc de 1134,98 g.mol-1, son numéro CAS est le 7585-39-9. De nombreux dérivés peuvent être obtenus à partir des cyclodextrines naturelles : les groupements hydroxyles des unités glucopyranose peuvent être aminés, estérifiés ou éthérifiés. La synthèse de ces dérivés a souvent pour but d'améliorer la solubilité. Parmi les cyclodextrines les plus étudiées on trouve la β-cyclodextrine (BCD, naturelle), l'hydroxypropyl-β-cyclodextrine (HPCD) et la méthyl-β-cyclodextrine (MCD). Les molécules chimiquement modifiées ont des masses molaires moyennes correspondantes à des indices molaires de substitution.
Toxicité
En général les cyclodextrines et leurs dérivés hydrophiles sont considérés comme pratiquement non-toxiques en administration par voie orale. En effet ces molécules ne diffusent quasiment pas au travers des membranes biologiques et ne sont pas absorbées lors du transit intestinal (DL50 oral, rat 18800 mg/kg pour la β-cyclodextrine, d'après MSDS). Ainsi dans un rapport de 1995, basé sur celui de 1993, l’OMS (Joint FAO/WHO Expert committee, 1993, 1995), donnait une Dose Journalière Admissible de 5 mg par kg de masse corporelle pour la BCD, basé sur une dose sans effet nocif (NOEL) de 1,25% dans le régime alimentaire chez le chien (coefficient de sécurité de 200). La FDA (Food and Drugs Agency) autorise son utilisation comme additif alimentaire à hauteur de 0,5 à 2% selon les produits. La BCD est ainsi utilisé dans l’industrie agro-alimentaire comme additif alimentaire (E459).
Ces molécules peuvent être considérées comme éco-compatibles et se dégradent dans le milieu naturel. Toutefois la cyclodextrine naturelle se dégrade plus facilement que les cyclodextrines modifiées : 82% de biodégradation de la BCD en 28 jour mais seulement 9% pour la HPCD et 9% pour la MCD.
Propriétés remarquables
Les cyclodextrines possèdent une structure en tronc de cône, délimitant une cavité en leur centre. Cette cavité présente un environnement carboné apolaire et plutôt hydrophobe (squelette carboné et oxygène en liaison éther), capable d'accueillir des molécules peu hydrosolubles, tandis que l'extérieur du tore présente de nombreux groupements hydroxyles, conduisant à une bonne solubilité (mais fortement variable selon les dérivés) des cyclodextrines en milieu aqueux. En particulier la β-cyclodextrine naturelle est pres de dix fois moins soluble que l'alpha ou la gamma. Grâce à cette cavité apolaire, les cyclodextrines sont capables de former des complexes d'inclusion en milieu aqueux avec une grande variété de molécules-hôtes hydrophobes. Une ou plusieurs molécules peuvent être encapsulées dans une, deux ou trois cyclodextrines.
La formation de complexe suppose une bonne adéquation entre la taille de la molécule hôte et celle de la cyclodextrine. L'intérieur de la cavité apporte un micro-environnement lipophile dans lequel peuvent se placer des molécules non polaires. La principale force provoquant la formation de ces complexes est la stabilisation énergétique du système par le remplacement dans la cavité des molécules d'eau à haute enthalpie par des molécules hydrophobes qui créent des associations apolaires-apolaires. Ces molécules hôtes sont en équilibre dynamique entre leur état libre et complexé. La résultante de cette complexation est la solubilisation de molécules hydrophobes très insolubles dans la phase aqueuse. Ainsi les cyclodextrines sont capables de complexer en milieu aqueux et ainsi solubiliser les composés hydrophobes (la polarité de la cavité est comparable à celle d'une solution aqueuse d'éthanol).
Utilisations
Utilisation en pharmacologie
Les cyclodextrines sont couramment utilisées comme excipient de formulation dans les médicaments. Elles permettent notamment de transformer des composés liquides en solides (poudres, comprimés) par précipitation des complexes d’inclusion. Les médicaments sont souvent des molécules hydrophobes, ce qui peut poser des problèmes d'assimilation par voie orale lors de la digestion. La complexation des principes actifs permet de mieux contrôler leur passage dans le circuit sanguin ou la progressivité de leur diffusion. Une autre application est le traitement par voie sub-linguale. La complexation des principes actifs photosensibles ou très réactifs permet souvent de les protéger ou de les stabiliser.
Utilisation en agroalimentaire
L'industrie agroalimentaire se sert communément (et depuis plus de 20 ans au Japon) des cyclodextrines comme exhausteur de goût en permettant un ajout facile de composés gustatifs ou pour fixer des molécules trop volatiles et prolonger par exemple la durée gustative des chewing-gums. Elles sont aussi utilisées pour au contraire enlever certaines molécules indésirables, notamment pour réduire les taux de cholestérols ou de composés amers des plats cuisinés. Les cyclodextrines sont aussi employées pour stabiliser des émulsions comme la mayonnaise ou même les margarines.
Utilisation en chimie analytique
Les cyclodextrines sont de plus en plus utilisées en chimie analytique, notamment en HPLC (Chromatographie en phase Liquide Haute Performance), comme greffe sur la phase stationnaire (silice en général). L'emploi de cyclodextrine permet de changer l’affinité des composés à analyser pour la phase stationnaire, et donc de modifier leur temps de rétention. Une propriété remarquable des cyclodextrines est qu'en complexant certaines molécules photosensibles, elles exaltent leur capacité de réponse à l'excitation (fluorimétrie notamment).
Utilisation en dépollution des sols
Les cyclodextrines présentent de bonnes caractéristiques pour être utilisées en dépollution des sols :
- elles sont considérées comme non-toxiques et biodégradables
- il n'y a pas de concentration minimale ou critique d'activité, comme c’est le cas pour les surfactants
- leur structure rigide et leurs groupements fonctionnels hydroxyles non ionisables leurs procurent une bonne stabilité physico-chimique en solution
- elles peuvent être chimiquement modifiées pour améliorer leur solubilité aqueuse
- leur coût est comparable aux surfactants usuels (bien que variable selon le type de cyclodextrine utilisée)
Cette utilisation est actuellement en voie de recherche. Deux voies principales sont explorées : la bioremédiation et l'extraction. La première approche est étudiée depuis les années 80, tandis que la seconde a émergée dans les années 90.
La bioremédiation consiste a profiter de la dégradation naturelle des polluants par les microorganismes du sol. Cette biodégradation peut être lente et faible, dépendant fortement de la toxicité des contaminants et de la capacité des microorganismes à les atteindre : c'est la biodisponibilité. En effet les microorganismes vivent dans un milieu aqueux et se nourrissent donc de composés dissous dans l'eau ou présent à l'interface de ce milieux. Les polluants hydrophobes, et donc très faiblement solubles dans l’eau sont ainsi très peu dégradés. Les cyclodextrines peuvent agir comme des surfactants éco-compatibles (pas d'altération de l'équilibre naturel de la flore bactérienne) pour améliorer fortement la biodisponibilité et donc la dégradation de molécules très peu solubles. Leur faible coût, leur biocompatibilité et leur effet accélérateur significatif en font un choix pertinent pour des expériences de bioremédiation.
Une autre approche de décontamination est l'extraction des polluants. Cette méthode est traditionnellement réalisée à l'aide de surfactants ou dans certains cas de solvants organiques, qui servent à évacuer dans une solution de lavage les polluants. Ces produits étant plus ou moins toxiques pour l'écosystème du sol, leur remplacement par des cyclodextrines apparaît comme une amélioration majeure de ce procédé. Les recherches actuelles montrent leur réelle efficacité sur les molécules comme les HAP, les PCB, les pesticides, les molécules d’explosifs et probablement de manière générale sur les polluants hydrophobes.
Utilisation diverses
- désodorisation : les cyclodextrines sont utilisées comme agent masquant contre les mauvaises odeurs (la complexation rend les molécules odorantes moins volatiles)
- cosmétique : elles permettent de stabiliser des émulsions et les molécules odorantes ou actives
- textiles spéciaux : elles sont utilisées pour fixer au tissus des composés actifs (parfums, antibactériens)
- catalyseur de réactions chimiques : en chimie organique, elles permettent de contrôler la régiolectivité de certaines réactions tout en améliorant le rendement, et permettent de travailler avec des molécules hydrophobes en milieu aqueux.
Notes et références
- ↑ 1, Menuel, S.; Joly, J.-P.; Courcot, B.; Elysée, J.; Ghermani, N.-E.; Marsua, A. "Synthesis and inclusion ability of a bis-β-cyclodextrin pseudo-cryptand towards Busulfan anticancer agent" Tetrahedron, 67, 7, 1706-1714 doi:10.1016/j.tet.2006.10.070
Voir aussi
Articles connexes
Liens externes
- Portail de la chimie
Catégories : Oligoside | Glucane | Macrocycle
Wikimedia Foundation. 2010.