- Diagramme de frost
-
Diagramme de Frost
Le diagramme de Frost permet de comparer rapidement les propriétés chimiques des éléments chimiques dans leurs divers degrés d'oxydation à un pH donné.
Soit un élément chimique A possédant les degrés d'oxydation i, j et k auxquels sont associés les potentiels redox standard Ei°(Ai, Ao) où Ai est l'élément A à son degré d'oxydation i, et Ao est le même élément à son degré d'oxydation 0.
Tracer un diagramme de Frost consiste à placer, dans un repère plan dont l'abscisse est le degré d'oxydation et l'ordonnée le produit du degré d'oxydation et du potentiel standard (i → O) associé, les points représentatifs de chaque degré d'oxydation.
Sommaire
Approche thermodynamique
La variation de l'enthalpie libre ΔG d'une réaction d'oxydoréduction dont le potentiel redox standard (sens oxydant → réducteur) est égale à E et pour laquelle le nombre d'électrons échangé vaut n, est égale à :
ΔrG° = - nFE°
où F est la constante de Faraday qui vaut 96500 C (la charge d'une mole d'électrons).
Soit, pour une réaction i → j
ΔrG°(i→j) = - nFE°(i/j)
Si l'on considère la réaction qui permet de passer d'un degré d'oxydation quelconque au degré zéro d'un élément donné, l'enthalpie libre (qui est une fonction d'état) de la réaction s'écrit, par application du premier principe :
ΔrG°(i→0) = ΔfG°(0) - ΔfG°(i)
Or
ΔfG°(0) = 0
Donc
ΔrG°(i→0) = - ΔfG°(i) = - nFE°(i/0)
Ou
ΔfG°(i)/F = nE°(i/0)
À une constante près l'ordonnée du diagramme de Frost représente donc l'enthalpie libre de formation de l'espèce de degré d'oxydation i.
La valeur de l'enthalpie libre ne variera pas selon le chemin réactionnel suivi, et ici, cela permettra de déterminer la variation de l'enthalpie libre entre deux degrés d'oxydation quelconques, et par là même le potentiel redox associé. L'application du premier principe permettra également de déterminer rapidement la stabilité thermodynamique de tel ou tel degré d'oxydation en étudiant la variation d'enthalpie libre des réactions de dismutation ou de médiamutation qui y mènent.
Exemple simple
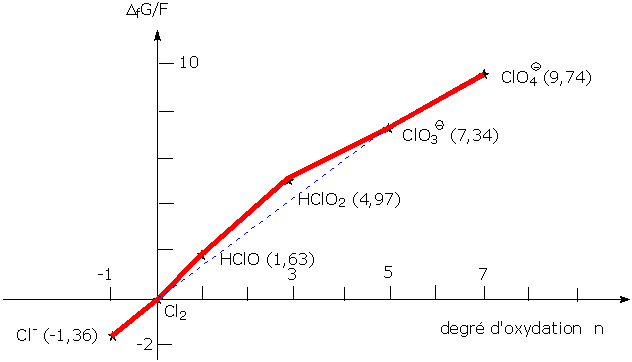
Nous allons tracer le diagramme de Frost du chlore, qui présente 7 degrés d'oxydation principaux :
Voici les espèces présentes à pH = 0
- -1 : Cl- : ion chlorure
- 0 : Cl2 : dichlore
- +1 : HClO : acide hypochloreux
- +3 : HClO2 : acide chloreux
- +5 : ClO3- : ion chlorate
- +7 : ClO4- : ion perchlorate
Les potentiels rédox par un couple X/dichlore (ou inversement s'il s'agit de l'ion chlorure) sont les suivants :
couple redox Potentiel redox standard (volts) Cl2/Cl- 1,36 HClO/Cl2 1,63 HClO2/Cl2 1,66 ClO3-/Cl2 1,47 ClO4-/Cl2 1,39
Les produits (nombre d'oxydation) x (potentiel redox) valent, pour chacun des degrés d'oxydation :
Cl- -1,36 Cl2 0 HClO 1,63 HClO2 4,97 ClO3- 7,34 ClO4- 9,74
Ces produits représentent l'enthalpie libre de formation ΔfG°de chaque structure divisée par F
Cela permet d'obtenir le graphe suivant[1]:
Utilisation prédictive du diagramme
Détermination des potentiels d'électrode standard
Ce diagramme est un outil simple qui permet de déterminer les potentiels rédox de tous les couples rédox pouvant exister entre les divers composés du chlore.
Par exemple, déterminons le potentiel rédox E° du couple HClO2/Cl-.
Celui-ci répond à l'équation
ΔrG°(HClO2 → Cl-) = - nFE°(HClO2/Cl-)
En appliquant le premier principe de la thermodynamique :
ΔrG°(HClO2 → Cl-) = ΔrG°(HClO2 → ½ Cl2) + ΔrG°(½ Cl2 → Cl-)
Or, nous connaissons ΔrG°(HClO2 → ½ Cl2) qui vaut + 3FE°(HClO2/Cl2) =4,97F, d'après la demi équation rédox :
HClO2 + 3 e- + 3 H + → ½ Cl2 + 2 H2O
De même, ΔrG°(½ Cl2 → Cl-) vaut FE°Cl2/Cl-) = 1,36F
Donc ΔrG°(HClO2 → Cl-) = 4,97F + 1,36F = 6,33F, pour la demi-équation rédox suivante :
HClO2 + 4 e- + 3 H + → Cl- + 2 H2O
où s'échangent quatre électrons.
Nous obtenons donc la relation :
ΔrG°(HClO2 → Cl-) = - 4FE°(HClO2/Cl-) = 6,33F
ou
E°(HClO2/Cl-) = 6,33/4 = 1,583 volts
L'application de ce même raisonnement permet de voir que le potentiel redox d'un couple donné est égal au coefficient directeur de la droite qui relie les points représentatifs sur le diagramme de Frost des deux membres de ce couple.
Exemple :
E°(ClO4-/ClO3-) = (9,74-7,34)/2 = 1,2 volts
On peut obtenir le même résultat très simplement parce que les ordonnées associées à chaque espèce représentent en fait leur enthalpie libre de formation divisée par F. Ainsi,
ΔrG°1→2 = ΔfG°2 - ΔfG°1
Donc,
(n2 - n1)FE°1→2 = n2FE°2 - n1FE°1
Ou
E°1→2 = (n2E°2 - n1E°1)/(n2 - n1)
L'application à l'exemple précédent donne bien 1,2 volts
Dismutation - Médiamutation
Il est facile de déterminer l'enthalpie libre d'une réaction donnée grâce aux valeurs de ΔG°/F données par le diagramme.
Cherchons à savoir si HClO2 est stable à pH = 0. Pour cela, étudions les réactions qui peuvent conduire à sa dismutation en Cl- et ClO3- par exemple. La réaction considérée est la suivante :
x HClO2 +… → y ClO3- + z Cl- +…
dont on va obtenir les coefficients en écrivant les demi équations rédox :
HClO2 + H2O → ClO3- + 3 H+ + 2 e- HClO2 + 3 H+ + 4 e- → Cl- + 2 H2O
en multipliant par 2 la première demi-équation, on peut additionner les deux en éliminant les électrons. Il vient :
3 HClO2 → 2 ClO3- + Cl- + 3 H+ (A)
L'enthalpie libre de cette réaction ΔrG°A vaut, à pH=0 :
ΔrG°A = 2 ΔfG°(ClO3-) + ΔfG°(Cl-) - 3 ΔfG°(HClO2)
soit
ΔrG°A = F*(2*7,34 + (-1,36) - 3*4,97) = - 1,59 F (Joules)
soit une enthalpie libre négative, ce qui indique que HClO2 est instable en milieu acide et se dismute.
Tracé du diagramme à d'autres pH
Grâce à l'Équation de Nernst, on peut déterminer les potentiels rédox standard à un pH quelconque, connaissant les constantes d'acidité des composés mis en jeu.
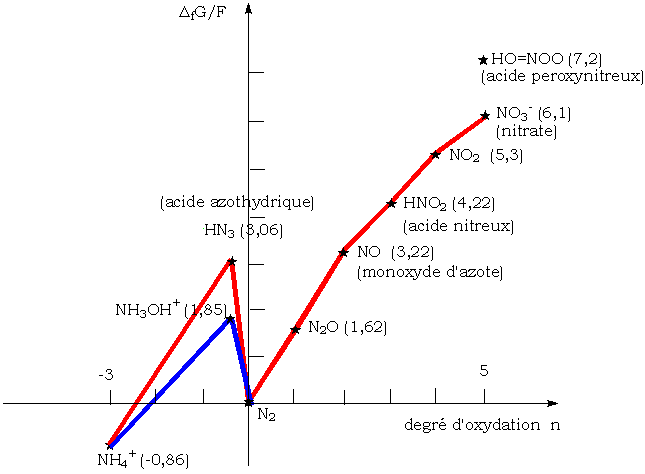
Tracés pour d'autres éléments
Diagramme de frost de l'azote à pH = 0
Notes et références
- ↑ Réalisé avec le logiciel Paint de Microsoft
- Portail de la chimie
Catégories : Électrochimie | Diagramme
Wikimedia Foundation. 2010.
