- Diagramme d'Ellingham
-
En chimie et en métallurgie, le diagramme d'Ellingham, ou diagramme d'Ellingham-Richardson, permet de prévoir les équilibres entre un métal et ses oxydes en fonction de la température et de la pression, ainsi que de connaître les réactions d'oxydoréduction thermodynamiquement possibles entre deux espèces.
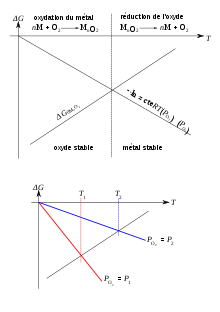
Le diagramme d'Ellingham représente l'enthalpie libre standard de formation d'un oxyde à partir d'un métal ou d'un oxyde inférieur dont l'équation bilan est ramenée à la consommation d'une mole de dioxygène en fonction de la température. Dans les diagrammes d'Ellingham, soumis à l'approximation d'Ellingham, les domaines de prédominance ou d'existence (pour les solides) sont séparés par des droites correspondant à l'équation de l'enthalpie libre en fonction de la température des différents couples étudiés. Au-dessus de la droite d'Ellingham, il y a prédominance de l'oxydant, et au-dessous, du réducteur ; l'affinité chimique de la réaction étant nulle sur la droite elle-même.
Lorsqu'il y a plusieurs métaux, celui dont la droite d'Ellingham est au-dessous réduit celui qui est au-dessus : on utilise souvent le coke, une des rares espèces dont la pente dans le diagramme est négative (réducteur universel), et qui est peu coûteux, pour réduire la majorité des métaux.
On peut aussi tracer des abaques sur le diagramme d'Ellingham, permettant d'étudier le rôle de la pression en dioxygène sur la réaction en fonction de la température ; et de noter que dans ces conditions, la majorité des métaux sont attaqués à pression et température ambiante.
Wikimedia Foundation. 2010.