- Composé carbonylé
-
La fonction carbonyle, C=O, où un atome de carbone est relié à un atome d'oxygène par une double liaison, est une fonction de chimie organique.
Les composés où le groupe carbonyle est le principal substituant sont :
On appelle donc en général ces deux types de composés, les composés carbonylés.
Note. Des fonctions possédant quelques similitudes sont présentes dans les acides carboxyliques et leurs dérivés (amides, anhydrides, chlorures d'acyle, esters…)
Sommaire
Nomenclature
Groupe principal
C'est le cas dans les aldéhydes et les cétones. Le nom du composé est donc celui de l'alcane correspondant, où le suffixe -ane est remplacé respectivement par -al et -one.
Lorsque les deux fonctions sont présentes, le groupe aldéhyde est considéré comme prioritaire par rapport au groupe cétone et impose donc le suffixe -al, s'il est le groupe principal.
Groupe secondaire
Lorsque le groupe carbonyle n'est pas le groupe principal dans une molécule (il est donc considéré comme substituant), il impose le préfixe oxo-, aussi bien dans le cas de cétones que d'aldéhydes.
Dans le cas des fonctions esters ou acides carboxyliques (et leurs dérivés), malgré la présence d'une liaison C=O, ce n'est pas un groupe carbonyle mais un groupe carboxyle (carbone niveau d'oxydation +III et non +II).
Placement autour de la fonction
La nomenclature des aldéhydes et des cétones a évolué.
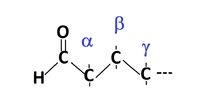
- L'atome de carbone accolé directement au groupe carbonyle était qualifié d'alpha, le suivait de bêta et ainsi de suite selon l'alphabet grec.
- Aujourd'hui, les positions sont nommées par des chiffres. L'atome de carbone du groupe carbonyle possède le chiffre le plus bas possible. C'est-à-dire que l'atome de carbone de l'aldéhyde sera le numéro "1", le carbone accolé directement au groupe carbonyle sera le numéro "2", le suivant numéro "3", etc.
Caractéristiques de la double liaison C=O dans les composés carbonylés
Géométrie
- Longueur : environ 120 pm. Il s'agit d'une liaison courte, donc forte.
- Géométrie VSEPR : la liaison C=O et les 2 autres atomes liés au carbone présentent une géométrie de type trigonale plane (angles d'environ 120 °).
Polarité
La liaison C=O est fortement polarisée. Les molécules comprenant le groupe carbonyle (en particulier les aldéhydes et cétones) présentent donc des moments dipolaires permanents importants (accentués par les doublets libres de l'oxygène). Ceux-ci sont en général compris dans l'échelle 1.5 - 4 Debye.
Spectroscopie
Infra-Rouge (IR)
- La liaison C=O des composés carbonylés présente une bande forte comprise entre 1690 et 1 750 cm−1 (vibration d'élongation de la liaison C=O). Elle peut parfois descendre sous 1 700 cm−1 en cas de phénomènes de conjugaison.
- Pour les aldéhydes, 2 bandes moyennes de valence de C-H (dans CHO) comprise entre 2750 et 2 900 cm−1.
Résonance Magnétique Nucléaire (RMN)
- du proton : uniquement pour les aldéhydes, δ = 9.5 - 10
Ce proton est fortement déblindé du fait de la circulation des électrons π de la double liaison C=O.
Énergie
L'énergie de liaison C=O est très importante (ce qui explique entre autres la difficulté à la casser), en moyenne de l'ordre de 750 kJ, soit plus du double de la simple liaison C-O (ce qui la différencie de la liaison C=C, dont l'énergie est inférieure au double de l'énergie d'une liaison C-C).
Caractéristiques physiques
- Les températures de changement d'état sont plus élevées que dans les alcanes équivalents.
- Contrairement à l'eau ou aux alcools, les atomes d'hydrogène sont liés en général à des atomes de carbone, d'électronégativité proche. Ils ne sont donc pas chargés positivement, ce qui entraîne l'absence de formation de liaisons hydrogène. Cela explique des températures de changement d'état plus basses que dans les alcools équivalents (→synthèse des aldéhydes).
Solvants
- Les composés carbonylés sont des composés aprotiques et polaires. Les aldéhydes sont trop réactifs pour être utilisés comme solvants. Par contre, certaines cétone, notamment l'acétone (propan-2-one) et la butan-2-one (ou méthyléthylcétone, MEK) sont d'un emploi courant comme solvant polaire aprotique. Si la fonction carbonyle possède un hydrogène en alpha du carbone, alors il a possibilité d'un équilibre avec l'énol correspondant ; le solvant est alors légèrement protique du fait de cet hydrogène à caractère acide. Bien que cette réaction soit lente, cette réaction devient problématique en présence de base forte, ces solvants ne seront donc pas employés dans ces conditions et on leur préférera d'autres solvants aprotiques polaires, comme par exemple le diméthylsulfoxyde (DMSO), le N,N-diméthylformamide (DMF) ou l'acétonitrile.
- Vu que seul l'atome d'oxygène peut participer aux liaisons hydrogène, la solubilité de ces composés dans l'eau est limitée. Elle l'est d'autant plus que la chaine carbonée (hydrophobe) est longue. Ainsi l'acétone est miscible (soluble en toutes proportions) avec l'eau mais au-delà d'une chaine de six atomes de carbone, la solubilité devient infime.
Ligands
- Le ligand carbonyle est très souvent utilisé comme ligand d'éléments métalliques (chimie organométallique), par exemple, pour former des catalyseurs.
Composés carbonylés énolisables
Les composé carbonylés énolisables sont des composé carbonylés ayant au moins un atome d'hydrogène sur le carbone en α de la fonction carbonyle. Ainsi peut se produire un équilibre de tautomérie entre le composé carbonylé et l'énol correspondant, c'est-à-dire un alcène avec une fonction alcool en position vinylique.
Équilibre céto-énolique :
Wikimedia Foundation. 2010.