- Chromate d'hydrogène
-
Acide chromique
Acide chromique 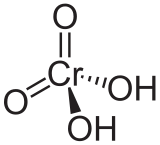
Général Nom IUPAC acide chromique No CAS No EINECS Propriétés chimiques Formule brute H2CrO4 [Isomères] Masse molaire 118,0096 g∙mol-1
H 1,71 %, Cr 44,06 %, O 54,23 %,pKa 0,8 Précautions Directive 67/548/EEC 
T+
O
NPhrases R : 9, 24/25, 26, 35, 42/43, 45, 46, 48/23, Phrases S : 43, 45, 60, 61, Transport 80 1755 [1]SIMDUT[2] 


Unités du SI & CNTP, sauf indication contraire. L'acide chromique est un diacide. C'est un oxacide de formule H2CrO4. Par la perte de deux protons (H+), il forme l'ion chromate.
En industrie et santé, la dénomination « acide chromique » est parfois également utilisée pour le trioxyde de chrome (CrO3) ou « anhydride chromique ». En pharmacie, le terme désigne une solution aqueuse à usage externe de chrome-trioxyde dénommée à tort « soluté officinal d'acide chromique », en application locale par tamponnement nasal, dilué au tiers, pour cautériser les épistaxis (saignements de nez).
Sommaire
Description
L'acide chromique et ses sels appelés chromates sont des composés du chrome à l'état d'oxydation +6. Ils ont donc des propriétés oxydantes très utilisées en chimie organique, par exemple pour l'oxydation de l'aniline en quinone. Le mélange Na2Cr2O7, dichromate de sodium, est un exemple de composé utilisé.
L'ion chromate de couleur jaune a tendance à se dimériser en solution aqueuse pour former l'ion dichromate de formule Cr2O72- de couleur orange. Dans certaines conditions, on obtient une polymérisation et la production de polychromates de formule CrnO3n+12- de couleur rouge.
Synthèse de l'acide
La synthèse se fait par oxydation de chrome-III en chrome-VI, qui peut, selon les conditions, donner un ion chromate, l'acide ou l'oxyde CrO3.
On peut remarquer qu'on trouve des chromates dans la nature comme le chromate de plomb PbCrO4.Utilisation
L'acide lui même est peu utilisé mais on se sert des chromates comme oxydant puissant et facile à utiliser en chimie organique. L'ion chromate peut aussi servir à précipiter certains ions en solution aqueuse en chimie analytique.
Toxicité
L'ion chromate est réputé être toxique contrairement aux dérivés du chrome III, et il faut prendre des précautions particulières pour utiliser les chromates.
Notes et références
- ↑ Entrée du numéro CAS « 7738-94-5 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- ↑ « Acide chromique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Voir aussi
Articles connexes
Liens externes
- Portail de la chimie
Catégories : Composé du chrome | Produit chimique très toxique | Produit chimique comburant | Produit chimique dangereux pour l'environnement | Produit chimique corrosif | Cancérogène chimique | Produit chimique mutagène | Réactif pour la chimie organique | Oxoacide
Wikimedia Foundation. 2010.

