- Chimie supramoléculaire
-
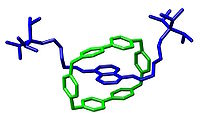
 Assemblage supramoléculaire établi par Jean-Marie Lehn et coll. dans Angew. Chem., Int. Ed. Engl. 1996, 35, 1838-1840.
Assemblage supramoléculaire établi par Jean-Marie Lehn et coll. dans Angew. Chem., Int. Ed. Engl. 1996, 35, 1838-1840.
La chimie supramoléculaire est une branche de la chimie qui repose sur les interactions non-covalentes ou faibles entre atomes au sein d'une molécule ou entre molécules, au sein d'un ensemble moléculaire. Son objectif est de comprendre ou de construire des édifices de taille nanométrique. Le principe est d'utiliser des briques moléculaires qui, une fois mélangées en solution, dans des conditions contrôlées, s'autoassemblent pour donner des édifices plus complexes. L'étude des interactions non-covalentes et des relations entre fonction et structure sont à la base de la compréhension des systèmes biologiques. Le monde biologique est souvent une source d'inspiration dans la modélisation d'assemblages supramoléculaires.
Sommaire
Origine
La chimie supramoléculaire étudie les interactions dites « non covalentes » c'est-à-dire n'impliquant pas la création de nouvelles orbitales moléculaires. Ce concept s'oppose à la chimie dite « moléculaire », qui s'occupe des liaisons covalentes au sein d'une molécule et reliant entre eux ses atomes. Même si un ensemble supramoléculaire peut acquérir des propriétés qu'il ne possédait pas avant l'établissement desdites liaisons non covalentes, chacune des molécules constituant la nouvelle « supermolécule » n'est en rien modifiée dans son intégrité chimique.
Cependant, l'architecture de l'assemblage supramoléculaire peut faire en sorte que certaines molécules soient rendues plus réactives par perturbation de leur nuage électronique ou déformation de leurs angles de liaison. Le rapprochement, au sein de l'entité supramoléculaire, de deux molécules naturellement portées à réagir ensemble peut aussi les pousser à réagir plus facilement que si elles avaient été libres dans un solvant. On parle alors de catalyse supramoléculaire (les enzymes sont l'exemple le plus connu de catalyseur supramoléculaire biologique).
Comparaison entre chimie moléculaire et chimie supramoléculaire
Chimie Moléculaire Supramoléculaire Interaction Intramoléculaire (entre atomes) Intermoléculaire (entre molécules) Liaison chimique Covalente Non covalente Produit de préparation Molécule Supermolécule (complexe) Processus de préparation Synthèse Complexation Voie fondamentale et voie appliquée
Deux types d'approches sont envisagés dans cette branche de la chimie. L'une, plutôt observatrice, tente d'expliquer, de comprendre, et de contrôler en partie des autoassemblages existants ; l'autre, plutôt orientée vers la synthèse, tente de concevoir des briques moléculaires données pour obtenir un édifice donné. Certaines synthèses, en particulier celles de ligands spécifiques d'un métal, sont obtenues en assemblant au préalable les synthons et le métal, puis en ajoutant les réactifs permettant la synthèse du ligand proprement dit (effet dit « template » utilisé dans la synthèse des cryptands ou des éthers couronnes par exemple).
L'effet « template » (ou de matrice) facilite en fin de compte la réaction tant sur le point de vue thermodynamique (le système récepteur/métal qui en résulte en fin de synthèse déplace l'équilibre de la réaction par sa grande stabilité) que sur le point de vue cinétique (la présence du métal rigidifie et contraint le système au niveau moléculaire de manière à rapprocher les extrémités qui sont censées réagir entre elles).Les différents modes d'interaction
Les interactions à la base de la chimie supramoléculaire peuvent être des interactions :
- de van der Waals. De 0,1 à 1 kcal/mol, elles sont non directionnelles et augmentent avec la surface de contact ;
- de type liaison hydrogène. De 1 à 10 kcal/mol, cette liaison est directionnelle et sa force dépend de la distance entre les sites donneur et accepteur ;
- aromatiques (recouvrement π-π, π-cation, π-liaison H). Ce sont des interactions non covalentes dues au recouvrement des orbitales p de cycles aromatiques avec d'autres cycles aromatiques, des orbitales p ou f de cations métalliques ou avec l'orbitale moléculaire d'un électron porté par un hétéroatome plus électronégatif (O, N, S, etc.) ;
- coulombiennes (ion/ion, ion/dipôle), dipolaire (dipôle/dipôle), par polarisation (ion/molécule polarisée). De 15 à 50 kcal/mol, ces interactions électrostatiques sont non directionnelles et dépendent de la distance entre les deux entités ;
- de coordination métal/ligand. De 50 à 80 kcal/mol, la directionnalité de la liaison dépend de la nature du métal et des autres constituants de sa sphère de coordination ;
- ou encore le résultat d'un effet hydrophobe.
Le phénomène de reconnaissance hôte/substrat, introduit par Emil Fischer avec le concept « clé-serrure », combine souvent plusieurs de ces interactions.
Formalisation
Jean-Marie Lehn (prix Nobel de chimie 1987) a permis de formaliser les concepts de la chimie supramoléculaire. Au cours de sa leçon inaugurale [1] au Collège de France, Jean-Marie Lehn introduit la chimie supramoléculaire comme suit : Au-delà de la chimie moléculaire, fondée sur la liaison covalente, s'étend ainsi un domaine qu'on peut nommer supramoléculaire: la chimie des interactions moléculaires, des associations de deux ou plusieurs espèces chimiques, les complexes, et de la liaison intermoléculaire.
Applications
Science des matériaux
La chimie supramoléculaire et les processus d'auto-assemblage moléculaires en particulier sont appliqués au développement de nouveaux matériaux. De nombreuses structures peuvent être obtenues facilement par synthèse ascendante (ou bottom-up) en composant à partir de petites molécules qui nécessitent peu d'énergie et d'étapes à synthétiser. Ainsi, la plupart des approches ascendantes en nanotechnologie sont basées sur la chimie supramoléculaire.
Catalyse
Une des applications majeures de la chimie supramoléculaire est la conception et la compréhension de catalyseurs et de la catalyse. Les interactions non covalentes sont importantes en catalyse, elles permettent aux réactifs de se lier dans des conformations appropriées à la réaction et abaissent l'énergie de l'état de transition de la réaction. Ainsi, la catalyse supramoléculaire influe sur le rendement et la sélectivité stéréochimique. En conséquence, un champ d´application est le développement d´enzymes artificielles et de réactifs moléculaires.
Médecine
La chimie supramoléculaire est aussi importante dans le développement de nouvelles thérapies médicales grâce à sa compréhension des interactions entre le principe actif et le système biologique. Le mode d'administration a aussi réalisé des progrès notables en raison des recherches en chimie supramoléculaire sur l'encapsulation et les mécanismes de libération ciblée. En outre, des systèmes supramoléculaires ont été conçus pour perturber les interactions protéine-protéine, qui sont importantes pour la fonction cellulaire.
Stockage d'information et calcul
La chimie supramoléculaire a été employée pour démontrer les possibilités de calcul numérique à l'échelle moléculaire. Dans de nombreux cas, des signaux photoniques ou chimiques ont été utilisés dans ces composants, mais l'interface électrique de ces unités a été également réalisée par des dispositifs supramoléculaires de transduction de signaux. Le stockage d'information a été rendu possible par l'utilisation de commutateurs moléculaires avec des unités photochromiques et photoisomérisables, par des unités électrochromiques et des interrupteurs rédox, et même par mouvement moléculaire. Des fonctions logiques moléculaires synthétiques ont été démontrées à un niveau conceptuel. Même des calculs complets ont été réalisés par des ordinateurs à ADN semi-synthétiques.
Chimie verte
La recherche en chimie supramoléculaire a aussi des applications en chimie verte, où des processus à l'état solide dirigés par liaisons non-covalentes ont été développés. De telles procédures sont fortement souhaitables puisqu'elles réduisent le besoin de solvants pendant la production des produits chimiques.
Autres applications
La chimie supramoléculaire permet aussi de préparer des senseurs, des transporteurs et des réactifs supramoléculaires.
Notes et références
Une partie de cet article est une traduction libre de certaines sections de l'article anglophone correspondant.
- Jean-Marie Lehn, Leçon inaugurale au Collège de France, 7 mars 1980. Pages des leçons inaugurales
Voir aussi
Articles connexes
Wikimedia Foundation. 2010.