- C3O2
-
Oxydes de carbone
Parmi les différents oxydes du carbone relativement stables schématisés en COx, il existe trois composés binaires sous forme de molécules géométriquement linéaires et symétriques[1] :
- C3O2, sous-oxyde équivalent à l'anhydride de la molécule d'anhydride malonique, sous-oxyde qu'il est possible de décrire en second anhydride de l'acide malonique.
- CO, le monoxyde de carbone ou trivialement oxyde de carbone.
- CO2, le dioxyde de carbone.
Comme les deux derniers composés binaires, les plus connus par une abondante littérature, font l'objet d'un article spécifique, un aperçu des propriétés et caractéristiques de la première molécule est présenté ci-dessous.C3O2 est un liquide peu stable aux conditions normales de température et de pression. Il polymérise facilement et forme un solide rouge, jaune et noir selon les longueurs de chaînes (C3O2)n. Ce composé fortement réactif et toxique peut être obtenu par une puisssante décomposition thermique de l'acide malonique en présence d'anhydride phosphorique.
Il est aussi obtenu par décomposition thermique sous pression réduite de l'anhydride diacétyltartrique.
Sous-oxyde de carbone 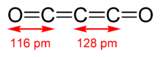
formule développée de C3O2 Général Nom IUPAC propa-1,2-diene-1,3-dione No CAS SMILES InChI Apparence gaz sans couleur Propriétés chimiques Formule brute C3O2 [Isomères] Masse molaire 68,0309 g∙mol-1
C 52,96 %, O 47,04 %,Propriétés physiques T° fusion −107 °C T° ébullition 6,8 °C Masse volumique 0.906 ± 0.06 g/cm3, gaz à 298 K Unités du SI & CNTP, sauf indication contraire. Histoire du sous-oxyde de carbone C3O2
Le sous-oxyde de carbone, ainsi dénommé par Marcellin Berthelot est découvert par Brodie en 1873, en soumettant à l'arc électrique le monoxyde de carbone. Cette dénomination nom a été contestée par Otto Diels et son école, qui refuse une appartenance inorganique et décrit une vraie molécule organique caractéristique, du type dicarbonyl méthane ou encore dioxallène par rapport aux liaisons supposées.
Par sa préparation, il est considéré comme l'anhydride de la molécule d'anhydride malonique. Enfin, Reyerson a mis au point diverses préparations au début des années trente. La polymérisation a donné une assurance accrue aux partisans de Diels.
Notes et références
- ↑ Pour la symétrie stricto sensu, ce n'est pas le cas du CO qui ne présente aucune propriété de symétrie par invariance de champs
- Portail de la chimie
Catégories : Composé du carbone | Oxyde
Wikimedia Foundation. 2010.
