- 4759-48-2
-
Isotrétinoïne
Isotrétinoïne 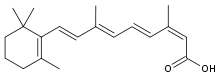
Général Nom IUPAC acide 13-cis-rétinoïque No CAS No EINECS Code ATC , PubChem SMILES InChI Propriétés chimiques Formule brute C20H28O2 [Isomères] Masse molaire 300,4351 g∙mol-1
C 79,96 %, H 9,39 %, O 10,65 %,Propriétés physiques T° fusion 172 à 175 °C Précautions Directive 67/548/EEC 
TPhrases R : 36/37/38, 61, Phrases S : 26, 36/37/39, 45, 53, Données pharmacocinétiques Métabolisme Foie Demi-vie d’élim. 21 heures Excrétion Fèces et urine Considérations thérapeutiques Voie d’administration Prescription Unités du SI & CNTP, sauf indication contraire. L'isotrétinoïne [1] est une substance active médicamenteuse utilisée dans le traitement de l'acné. C'est un rétinoïde, c'est-à-dire un dérivé de la vitamine A présent naturellement dans le corps, produit par le foie en petite quantité. Il s'agit de la substance considérée comme la plus efficace [2] contre l'acné, elle est généralement réservée afin de traiter les acnés sévères résistantes aux traitements antibiotiques associés à des topiques pendant 3 mois. L'Isotrétinoïne est la substance active de divers médicaments comme Curacné ® ou Roaccutane ® [3].
Indiquée pour :
Acné récalcitrant nodulaire grave
Contre-indications :
Grossesse et/ou Lactation
Hypersensibilité à l'isotrétinoïne
Sensibilité aux parabènesInteractions :
Effet secondaires : Grave :
Tératogène (Déficiences congénitales graves)
SuicideCardiovasculaire :
Palpitation, Tachycardie, Accident Vasculaire Cérébral, maladie thrombotique vasculaireNez, gorge et oreille :
Perte d'audition, acouphèneEndocrine :
Hypertriglycéridémieœil :
Opacité de la cornée, baisse de la vision nocturne, cataracte, trouble de la vision des couleurs, conjonctivite, sicca, inflammation de la paupière, kératite, névrite optique, photophobie, troubles de la vueGastro-intestinales :
Nausée, côlon irritable, hépatite, pancréatite, saignements et inflammations des gencives, colite, œsophagite/ulcère de l'œsophage, iléite, rectite, diarrhée sanglante, appendicite aiguëHématologie :
Réactions allergiques, anémie, thrombocytopénie, neutropénie, agranulocytoseMuscle et/ou squelette :
Hyperostose, calcification des tendons et des ligaments, soudure prématurée des cartilages épiphysaires, chute de la densité osseuse, arthrite, tendinite, rhabdomyolyseNeurologie :
Pseudotumeur cérébral, vertige, somnolence, céphalée, insomnie, léthargie, malaise, nervosité, paresthésie, épilepsie, AVC, syncope, faiblesse généralePsychologique :
Pensée morbide, tentative de suicide, suicide, dépression [4], psychose, irritabilité, comportement agressif, instabilité émotionnelleRespiratoire :
Bronchospasmes, infection pulmonaire, altération de la voixPeau :
Acné fulminans, alopécie, meurtrissures, cheilitis, bouche sèche, nez sec, peau sèche, épistaxis, éruption xanthomas, rougeur, fragilité de la peau, anomalie des cheveux, hirsutisme, hyperpigmentation, hypopigmentation, infections, dystrophie des ongles, panaris, desquamation de la paume des pieds et des mains, réaction photoallergénique/photosensibilité, prurit, pyogenic granuloma, éruptions cutanés, sensibilité au coups de soleil accrue, sueurs, urticaire, ulcérations, cicatrisation anormaleUrogénital et reproduction :
Menstruations anormalesSommaire
Indications
Acné sévère ayant résisté à tout autre traitement antiacnéique [antibiotique & topics].
Pharmacodynamique
Pharmacocinétique
Absorption
Orale [Roaccutane®], Curacne® ou locale [Roaccutane® Gel, Isotrex®].
Distribution
Métabolisme
Élimination
Interactions
L'Isotrétinoïne ne doit pas être administrée conjointement aux tétracyclines [Hypertension intracrânienne].
Historique
Le médicament a été à la base conçu pour les cancéreux qui pratiquaient de la chiomiothérapie. Dans les années 1970, le laboratoire Hoffmann-La Roche [5] commença un programme de synthèse de rétinoïdes dans le but de réduire leurs effets secondaires. W. Bollag eut l'idée d'utiliser l'isomère 13-cis de l'acide rétinoïque. Celui-ci présente une efficacité thérapeutique dans des cas d'acnés vulgaires et sévères et des effets secondaires réduits par rapport à l'acide rétinoïque. Cette molécule, l'isotrétinoïne, fut développée en 1982 pour le traitement des acnés sévères par voie orale.
Dates clés dans l'histoire américaine de l'Accutane (Roaccutan).
1971 : Roche développe le Roaccutan, appelé Accutane aux États-Unis.
1982 : la FDA (Food and Drug Administration) autorise l'Accutane pour soigner les formes sévères d'acné ayant résisté à d'autres traitements.
1986 : Roche change la notice d'emballage de l'Accutane pour signaler que des utilisateurs ont rapporté des symptômes de dépression.
1988 : Public Citizen pétitionne [6] la FDA pour une interdiction de l'Accutane
1997 : les instances françaises de régulation exigent de Roche d'indiquer le suicide comme un effet secondaire possible. Des données d'études d'un docteur de Roche sur la dépression chez des patients sous Accutane amènent ce médecin à recommander que les utilisateurs soient supervisés pour les signes de dépression.
Février 1998 : la FDA informe que la notice d'emballage de l'Accutane devra inclure un avertissement disant que des utilisateurs ont rapporté [7] des réactions adverses incluant la dépression, des syndromes psychotiques et « rarement des idées de suicide, des tentatives de suicide et le suicide »
Mars 1998 : les instances anglaises et irlandaises de régulation exigent un avertissement sur le risque de troubles psychiatriques produits par l'Accutane.
Décembre 1999 : Roche présente à la FDA un rapport sur les troubles psychiatriques, concluant qu'aucun des 168 constats de comportement suicidaire ne peut être directement lié à l'Accutane.
Mai 2000 : Roche change la notice d'emballage de l'Accutane et inclut les effets indésirables possibles de la dépression, rarement des pensées suicidaires, des tentatives de suicide et du suicide.
Septembre 2000 : durant une audition devant le Comité consultatif dermatologique et ophtalmologique de la FDA, un des médecins intervenants (invité par la FDA et non par le laboratoire Roche) indique qu'entre 1982 et 2000, la FDA a reçu des rapports faisant état de 37 cas de suicide chez des personnes traitées par Accutane (24 cas) ou venant d'arrêter le traitement (13 cas). Il fait également état pendant la même période de 110 cas d'hospitalisation pour dépression, idées suicidaires ou tentatives de suicide[8].
Octobre 2000 : les Archives de dermatologie (Archives of Dermatology) publient une recherche financée par Roche. L'étude porte sur 20.895 patients souffrant d'acné qui prennent soit de l'Accutane soit des antibiotiques ; elle n'a trouvé aucun lien entre l'Accutane et le risque accru de dépression, de suicide ou d'autres troubles psychiatriques.
20 juin 2002 : l'information de l'Accutane est changée pour prévenir de la dépression, de syndromes psychotiques et, « rarement, d'idées de suicide, de tentatives de suicide, de suicide et de comportements agressifs ou violents »
Septembre 2003 : le Journal de l'Académie américaine de dermatologie (Journal of the American Academy of dermatology) publie une étude financée par Roche, qui n'a trouvé aucun accroissement significatif des prescriptions d'antidépresseurs chez les patients déjà sous Accutane.
18 novembre 2004 : David Graham, scientifique de la FDA, dit à une commission d'enquête du Sénat que le médicament devrait être étudié pour son retrait possible
23 novembre 2004 : la FDA exige un test de grossesse et que celui-ci soit négatif avant de prescrire le médicament.
Effets secondaires
De nombreux effets secondaires et indésirables constatés ou attendus chez les patients traités par isotrétinoïne sont similaires à ceux décrits chez les patients prenant de fortes doses de vitamine A (hypervitaminose A).
Les effets secondaires les plus fréquents touchent la peau. Les effets secondaires courants sont les suivants : douleurs et gonflement des lèvres (96 %), éruption cutanée sur le visage (55 %), nez sec (51 %), desquamation de la peau (50 %), démangeaisons (30 %), peau sèche (22 %), yeux rouges (19 %), chute de cheveux (13 %), irritation des yeux (11 %), éruption cutanée(< 10 %) Une sécrétion de sueur accrue et parfois persistante. Une sécheresse à l'intérieur du nez peut être associée à une légère hémorragie. Une inflammation des yeux légère à modérée peut être soulagée par une pommade ophtalmique. Dans de rares cas : chute de cheveux persistante après traitement, apparition d'angiomes (taches rouges).
De même on remarquera systématiquement des vertiges ainsi que diverses douleurs aux débuts du traitement durant 1 à 2 jours.
L'isotrétinoïne entraîne souvent une sécheresse des yeux. Les personnes qui portent des lentilles de contact peuvent être gênées.
Environ 13 % des patients souffrent de douleurs articulaires pendant le traitement.
Une desquamation de la peau de la paume des mains et de la plante des pieds, des infections de la peau, une sensibilité accrue aux coups de soleil, des symptômes uro-génitaux non spécifiques, des symptômes gastriques non spécifiques, des maux de tête, une fatigue surviennent chez environ 5 % des patients.
Une baisse de la vision nocturne a également été rapportée et a persisté dans de rares cas. Des cas de cataracte et de troubles de la vision ont également été signalés.
Effets psychologiques
Des études ont montré que beaucoup de patients mâles suivant un traitement d'isotrétinoïne ont démontré une sensibilité anormalement accrue à la testostérone, ainsi que plusieurs symptômes psychologiques et physiologiques reliés, tels une irritabilité et une anxiété inhabituelles, une confiance en soi gonflée outre-mesure ainsi qu'une augmentation marquée de l'appétit sexuel. Aucun de ces symptômes n'a perduré plus d'un mois après la fin des traitements. Am J Psychiatry 2007;122(5):996-67 ←(Source introuvable sur le site officiel, demande de correction ou de suppression de la source, les volumes de 2007 ont le numéro 164 et non 122). PMID 16363402
Un autre aspect psychologique important concerne quelques patients atteints d’acné sévère avec des attentes excessives vis-à-vis du traitement de leur acné. Ces patients estiment que la disparition de leur acné résoudra leurs difficultés personnelles et sociales. De tels espoirs déçus peuvent intensifier leur sentiment d’échec et précipiter une crise émotive voire une dépression. C'est pourquoi, des symptômes dépressifs aigus, pendant le traitement par l’isotrétinoïne, ont été rapportés chez une minorité de patients (généralement sans antécédents): selon Wysowski et al., de 1982 à mai 2000, la FDA s’est vue notifier 431 cas de dépression, idées suicidaire, tentatives de suicide et suicides chez des patients américains traités par isotrétinoine à la dose de 1 mg/kg/jour pour acné sévère. trente-sept patients se sont suicidés, 24 au cours du traitement d’une durée de trois mois en moyenne et 13 alors que le traitement était arrêté depuis deux mois et demi en moyenne. Trente et un patients sur 37 étaient de sexe masculin âgés en moyenne de 17 ans (extrêmes de 13 à 32 ans). Enfin 8 des 37 patients avaient des antécédents psychiatriques.[9]
Tératogénicité
L'Isotrétinoïne peut entraîner une malformation du fœtus chez la femme enceinte [risque estimé à 30%].
Un moyen de contraception pendant le traitement chez la femme est obligatoire.
Voir aussi
Notes et références
- ↑ (en) Drugs.com Isotretinoin Information
- ↑ (en) Bumps in the night: The Accutane story is all scare and no science (Reason Online)
- ↑ (en) FDA's Accutane Information Page
- ↑ (en) Skin deep: Accutane didn't depress me, it helped me live again (Reason Online)
- ↑ (en) Hoffmann-La Roche (Makers of (Ro)accutane)
- ↑ (en) Accutane Action Group (Group of people who suffered continuing side effects from isotretinoin).
- ↑ (en)Acne.org Message board (provides a forum on which many people keep diaries on Accutane use)
- ↑ (en) FOOD AND DRUG ADMINISTRATION - CENTER FOR DRUG EVALUATION AND RESEARCH - MEETING OF THE DERMATOLOGIC AND OPHTHALMIC DRUGS ADVISORY COMMITTEE 19 septembre 2000 (voir page 115)
- ↑ http://www.md.ucl.ac.be/loumed/Numero%2008/214685-LMed%20291-298.pdf
Liens externes
 Isotrétinoïne (formes orales)
Isotrétinoïne (formes orales)
Noms commerciaux :
- CONTRACNE® (France),
- CURACNE® (France),
- Isotrétinoïne-Mepha® (Suisse),
- ISOSUPRA® (Belgique)
- Isotretinoine-Ratiopharm® (Belgique),
- Liderma® (Suisse),
- PROCUTA® (France),
- Roaccutane® (Belgique, France, Suisse),
- Trétinac® (Suisse),
(pas pendant la grossesse et le mois précédent)
Classe :
RétinoïdeAutres informations :
Sous classe : Isotrétinoïne (usage externe)
Isotrétinoïne (usage externe)
Noms commerciaux :
- Retinova® (Belgique),
- Roaccutane gel® (France, Suisse)
(pas pendant la grossesse)
Classe :
RétinoïdeAutres informations :
Sous classe :
Anti-acnéique Adapalène | Acitrétine | Isotrétinoïne | Clindamycine | Peroxyde de benzoyle | Acide salicylique - Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique reprotoxique | Principe actif | Rétinoïde | Acide carboxylique
Wikimedia Foundation. 2010.
