- Benzène-1,4-diol
-
Hydroquinone
Hydroquinone 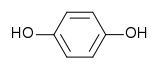
Formule semi-développée de l'hydroquinone Général Nom IUPAC benzène-1,4-diol Synonymes 1,4-Dihydroxybenzol, Eldoquin, Chinol No CAS No EINECS PubChem SMILES InChI Apparence cristaux incolores[1] Propriétés chimiques Formule brute C6H6O2 [Isomères] Masse molaire 110,1106 g∙mol-1
C 65,45 %, H 5,49 %, O 29,06 %,Propriétés physiques T° fusion 172 °C[1] T° ébullition 287 °C[1] Solubilité dans l'eau à 15 °C : 5.9 g/100 ml[1] Masse volumique (eau = 1) : 1.3[1] T° d’auto-inflammation 515 °C[1] Point d’éclair 165 °C[1] Pression de vapeur saturante à 20 °C : 0.12 Pa[1] Précautions Directive 67/548/EEC 
Xn
NPhrases R : 22, 40, 41, 43, 50, 68, Phrases S : (2), 26, 36/37/39, 61, Transport - 2662 NFPA 704 SIMDUT[3] 
SGH[4] 


DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Écotoxicologie LogP 0.59[1] Unités du SI & CNTP, sauf indication contraire. L'Hydroquinone, aussi appelée benzène-1,4-diol, est un composé organique aromatique apparenté au phénol, de formule suivante C6H4(OH)2 et qui se présente sous une poudre solide dans les conditions normales de pression et de température.
Sa structure comporte deux groupes hydroxyles liés à un noyau benzénique en position para.
Sommaire
Propriétés
L'hydroquinone est un agent réducteur. Ce dérivé de glucide freine également la synthèse de la mélanine par inhibition de la formation de l'enzyme tyrosinase.
Utilisations
L'hydroquinone en solution aqueuse a de nombreuses utilisations principalement en raison de son action comme agent réducteur. C'est l'un des composants majeurs dans le développement photographique où, en présence de Metol (ou 4-(méthylamino)phénol), elle réduit les sels d'argent exposés, invisibles, en argent métallique.
En médecine humaine, l'hydroquinone a été utilisée en application sur la peau pour en réduire la couleur sans risque de dermatoses. Toutefois cet usage est interdit dans l'Union européenne depuis février 2001, par crainte d'effets cancérigènes et de « complications graves ».
En synthèse des polymères, elle sert d'inhibiteur afin de prévenir une polymérisation prématurée du monomère, due par exemple au dioxygène de l'air (c'est un biradical) qui peut amorcer la polymérisation. [Chimie dans la maison, chapitre 23]
Toxicité
Dans une perspective écologique, comme tous les produits de développement, l'hydroquinone est dangereuse pour les écosystèmes et notamment pour les eaux car elle est peu biodégradable et en partie toxique pour les poissons. Ce produit est nocif car il contient du benzène, un dérivé du phénol notamment. Une fois utilisé, comme les huiles ou les piles usagées, ce produit doit être déposé dans une décharge spécialisée pour ne pas polluer l'environnement. Le révélateur peut faire l'objet d'un traitement thermique dans une installation chimique appropriée.
Annexes
Notes et références
- ↑ a , b , c , d , e , f , g , h et i HYDROQUINONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Hydroquinone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
[1] Fiche toxicologique de l'INRS (pdf).
Articles connexes
- Phénol
- Résorcine son isomére méta
- Pyrocatéchol son isomére ortho
Liens et documents externes
- (en) HYDROQUINONE International Occupational Safety and Health Information Centre (CIS)
- Portail de la chimie
- Portail de la médecine
- Portail de la photographie
- Portail de la pharmacie
Catégories : Produit chimique nocif | Produit chimique dangereux pour l'environnement | Polyphénol | Pharmacologie
Wikimedia Foundation. 2010.

