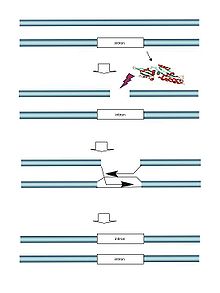
- Méganucléase
-
Les méganucléases sont des endodésoxyribonucléases (nucléases d'ADN) qui se caractérisent par un site de reconnaissance de grande taille (des séquences d’ADN double-brin de 12 à 40 paires de bases), ce qui fait qu’il est généralement présent en un seul exemplaire dans un génome donné. Pour prendre un ordre de grandeur, il faut 20 fois la taille du génome humain pour espérer rencontrer 1 fois la séquence de 18 paires de bases reconnue par la méganucléase I-SceI. Les méganucléases sont donc considérées comme les enzymes de restriction les plus spécifiques.
Parmi les méganucléases, les endonucléases de homing de la famille LAGLIDADG sont devenues depuis une quinzaine d’année des outils privilégiés pour l'étude et pour l’ingénierie des génomes, qui recouvre les stratégies et les techniques récemment développées pour modifier de façon ciblée et spécifique l’information génétique - ou génome - des organismes vivants.
Les méganucléases sont des « ciseaux moléculaires à ADN » que l’on peut utiliser pour remplacer, supprimer ou modifier des séquences de façon extrêmement ciblée. En modifiant leur site de reconnaissance par ingénierie de protéines, on peut modifier la séquence ciblée. Les méganucléases sont employées pour modifier toutes sortes de génomes – bactériens, végétaux, animaux – et ouvrent de larges possibilités d’innovation, notamment en santé humaine (élimination de matériel génétique viral ou « réparation » de gènes altérés) et en agriculture biotechnologique.
On rencontre les méganucléases chez un grand nombre d’organismes : archaea ou archéobactéries, bactéries, phages, champignons, levures, algues, certaines plantes. Elles peuvent être exprimées dans différents compartiments de la cellule : noyau, mitochondries, chloroplastes. Plusieurs centaines de ces enzymes ont été identifiées.
Sommaire
Deux familles principales
Les méganucléases sont surtout représentées par deux grandes familles d’enzymes regroupées sous le terme d’endonucléases de homing : les endonucléases introniques et les intéines. Dans la nature, ces protéines sont codées par des éléments génétiques mobiles, des introns ou des intéines. Les introns se propagent en s’intégrant à un endroit précis de l’ADN et en provoquant, grâce à la méganucléase exprimée, la cassure de l’allèle complémentaire qui ne contient pas l’élément mobile. Dans le cas des introns de groupe I et des intéines, la cassure induit la duplication de l’élément mobile au niveau du site de coupure grâce à l’intervention du mécanisme de recombinaison homologue de l’ADN double-brin.
On ne connait pas bien la fonction précise des méganucléases. L’hypothèse la plus répandue est que le matériel génétique qui les code fonctionne comme un élément parasite utilisant les mécanismes cellulaires de réparation de l’ADN double-brin à son profit, pour se multiplier et se transmettre, tout en n’altérant pas le matériel génétique de leur hôte.
Les endonucléases de homing de la classe LAGLIDADG
On distingue cinq familles, ou classes, d’endonucléases de homing[1].
La plus représentée et la mieux connue est la famille appelée LAGLIDADG. On la rencontre surtout dans les mitochondries et les chloroplastes d’organismes unicellulaires eukaryotes. Son nom correspond à une chaîne d’acides aminés que l’on retrouve, de façon plus ou moins conservée, chez toutes les protéines de cette famille. Ces petites protéines présentent aussi la particularité de présenter des structures tridimensionnelles compactes et très proches les unes des autres.
Parmi les endonucléases les mieux caractérisées et les plus utilisées en recherche et en ingénierie des génomes, on peut citer I-SceI (découverte dans des mitochondries de la levure de boulanger Saccharomyces cerevisiae), I-CreI (issue des chloroplastes de l’algue verte Chlamydomonas reinhardtii) et I-DmoI (issue de l’archéobactérie Desulfurococcus mobilis).
Les endonucléases LAGLIDADG les mieux connues sont des homodimères (par exemple I-CreI, composée de l’association de deux exemplaires du même domaine protéique) ou bien des monomères présentant une symétrie interne (I-Scel). Le site de liaison sur l’ADN, qui contient le domaine catalytique, est constitué de deux parties réparties de part et d’autre du point de coupure. Les demi-sites de liaison peuvent être extrêmement similaires, et se fixer sur une séquence d’ADN quasi-palindromique (I-Crel), ou être différents (I-SceI).
Les méganucléases comme outils d’ingénierie des génomes
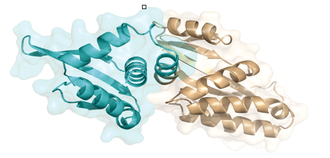 La méganucléase chimérique Dmo-Cre; extrait de l'article Grizot S, Epinat JC, Thomas S, Duclert A, Rolland S, Pâques F, and Duchateau P. (2010) Generation of redesigned homing endonucleases comprising DNA-binding domain derived from two different scaffolds. Nucleic Acids Research. 38(6): 2006–2018. © The Author(s) 2009. Published by Oxford University Press.
La méganucléase chimérique Dmo-Cre; extrait de l'article Grizot S, Epinat JC, Thomas S, Duclert A, Rolland S, Pâques F, and Duchateau P. (2010) Generation of redesigned homing endonucleases comprising DNA-binding domain derived from two different scaffolds. Nucleic Acids Research. 38(6): 2006–2018. © The Author(s) 2009. Published by Oxford University Press.
Du fait de leur grande spécificité, qui leur confère une haute précision et une bien moindre toxicité cellulaire que d’autres enzymes de restriction, les méganucléases ont été identifiées dès les années 1990 comme des outils de modification du génome particulièrement prometteurs.
Néanmoins, la réalisation de recombinaisons génétiques induites par des méganucléases était limitée par le répertoire disponible. En effet, même si des centaines de méganucléases existent dans la nature, et même si chacune d’entre elles tolère de petites variations de son site de reconnaissance, la probabilité de trouver une méganucléase susceptible de couper un gène donné à l’endroit voulu est extrêmement mince. L’ingénierie de nouvelles méganucléases pourvues du site de reconnaissance souhaité est donc rapidement devenu l’objectif de plusieurs laboratoires de recherches. Les recherches et les applications les plus poussées portent sur les endonucléases de homing de la famille LAGLIDADG.
Pour créer des méganucléases « à façon », deux grands types d’approches ont été déployés :
- La modification de la spécificité de méganucléases existantes[2],[3],[4], en introduisant un petit nombre de variations dans leur chaîne d’acides aminés et en sélectionnant ensuite les protéines fonctionnelles sur des « mutants » du site de reconnaissance naturel.
- Plus radicalement, l’exploitation d’une propriété qui joue un rôle important dans la grande diversification naturelle des méganucléases : la possibilité d’associer ou de fusionner des domaines protéiques issus d’enzymes différentes[5],[6]. Cette piste permet de concevoir des méganucléases chimériques munies d’un site de reconnaissance nouveau, constitué pour moitié d’un demi-site de la méganucléase A et pour autre moitié d’un demi-site de la protéine B. En fusionnant des domaines protéiques de I-Dmol et I-Crel, deux méganucléases chimériques ont ainsi été créées, E-Drel[7] et DmoCre.
Ces deux approches peuvent être combinées pour multiplier les possibilités de création de nouvelles enzymes, tout en conservant une efficacité et une spécificité élevées. Les scientifiques de Cellectis, une entreprise française de biotechnologie, ont ainsi mis au point une collection de plus de 20 000 domaines protéiques issus de la méganucléase homodimérique I-CreI et d'autres structures de méganucléases[8]. Ils peuvent être combinés en hétérodimères chimériques fonctionnels réalisés sur mesure pour des laboratoires de recherche ou pour des acteurs industriels. Une large banque comprenant plusieurs dizaines de milliers d’unités protéiques a ainsi été créée. Elles peuvent être combinés afin d’obtenir des méganucléases chimères reconnaissant le site visé, et de disposer ainsi d’outils de recherche et de développement pouvant répondre à des besoins très variés (recherche fondamentale, santé, agriculture, industrie, énergie…).Cette technique a notamment permis de mettre au point de nombreuses méganucléases spécifiques de séquences génétiques de virus, de plantes… et de produire de façon industrielle deux méganucléases capables de cliver le gène humain XPC dont la mutation est en cause dans le Xeroderma pigmentosum, une maladie monogénique grave prédisposant aux cancers cutanés et aux brûlures dès lors que la peau est exposée aux rayons UV[9].
Une autre approche consiste à essayer de prédire aussi précisément que possible, en s’appuyant sur des modèles informatiques, l’activité des méganucléases modifiées et la spécificité de la séquence nucléique reconnue[10]. Le « Northwest Genome Engineering Consortium », un consortium américain financé par le National Institutes of Health, s’est engagé dans cette voie avec pour objectif le traitement des leucémies par intervention sur les cellules souches hématopoïétiques. La prédiction du modèle est vérifiée et orientée par la mise en œuvre d’une mutagenèse dirigée et d’une analyse biochimique in vitro.
Articles connexes
Notes et références
Vidéo explicative sur les méganucléases réalisée par Cellectis
- BL. (2006) Homing endonuclease structure and function. Quarterly Reviews of Biophysics 38, 1, pp. 49–95.
- LM, Chisholm KM, Chevalier BS, Chadsey MS, Edwards ST, Savage JH, Veillet AL. (2002) Mutations altering the cleavage specificity of a homing endonuclease. Nucleic Acids Research. 30:3870-3879.
- D, Chadsey M, Fauce S, Engel A, Bruett A, Monnat R, Stoddard BL, Seligman LM. (2004) Isolation and Characterization of New Homing Endonuclease Specificities at Individual Target Site Positions. Journal of Molecular Biology. 342:31-41.
- Rosen LE, Morrison HA, Masri S, Brown MJ, Springstubb B, Sussman D, Stoddard BL, Seligman LM. (2006) Homing endonuclease I-CreI derivatives with novel DNA target specificities. Nucleic Acids Research. 34:4791-4800.
- S, Chames P, Perez C, Lacroix E, Duclert A, Epinat JC, Stricher F, Petit AS, Patin A, Guillier S, Rolland S, Prieto J, Blanco FJ, Bravo J, Montoya G, Serrano L, Duchateau P, Pâques F. (2006) Engineering of Large Numbers of Highly Specific Homing Endonucleases that Induce Recombination on Novel DNA Targets. Journal of Molecular Biology. 355:443-458.
- J, Grizot S, Arnould S, Duclert A, Epinat JC, Chames P, Prieto J, Redondo P, Blanco FJ, Bravo J, Montoya G, Pâques F, Duchateau P. (2006) A combinatorial approach to create artificial homing endonucleases cleaving chosen sequences. Nucleic Acids Research. 34(22):e149.
- BS, Kortemme T, Chadsey MS, Baker D, Monnat RJ, ad Stoddard BL. (2002) Design, activity, and structure of a highly specific artificial endonuclease. Mol Cell. 10(4):895-905.
- S, Epinat JC, Thomas S, Duclert A, Rolland S, Pâques F, and Duchateau P. (2010) Generation of redesigned homing endonuceases comprising DNA-binding domain derived from two different scaffolds. Nucleic Acids Research. 38(6): 2006–2018.
- P, Prieto J, Munoz IG, Alibès A, Stricher F, Serrano L, Cabaniols J-P, Daboussi F, Arnould S, Perez C, Duchateau P, Pâques F, Blanco FJ, Montoya G (2008). Molecular basis of Xeroderma pigmentosum group C DNA recognition by engineered meganucleases. Nature; 456(7218): 107-111.
- Ashworth J, Taylor GK, Havranek JJ, Quadri SA, Stoddard BL, Baker D (2010). Computational reprogramming of homing endonuclease specificity at multiple adjacent base pairs. Nucleic Acid Research; 38(16): 5601-5608.
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.