- Legionella
-
 Légionelles
Légionelles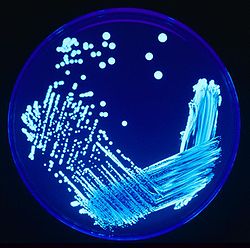
Culture de Legionella sp. sous UV Classification Règne Bacteria Embranchement Proteobacteria Classe Gamma Proteobacteria Ordre Legionellales Famille Legionellaceae Genre Legionella
Brenner et al., 1979Les bactéries du genre Legionella, les légionelles, sont des bacilles à gram négatif.
Sommaire
Écologie
Ce sont des bactéries naturellement présentes dans l’eau et dans les boues, responsables d'une maladie respiratoire, la légionellose. Elles colonisent fréquemment les réseaux d’eau, notamment les réseaux d’eau chaude sanitaire, les installations de climatisation ainsi que les tours aéro-réfrigérantes.
Conditions de prolifération
Les légionelles se développent et prolifèrent :
- dans l’eau stagnante ;
- lorsque la température est comprise entre 25 et 45 °C ;
- en présence de dépôts de tartre
- en présence de corrosion avec résidus métalliques (de fer, zinc) ;
- dans le « biofilm »[1],[2] et/ou sous forme planctonique ;
- à l'intérieur des protozoaires comme les amibes (14 espèces reconnues être leurs hôtes naturels et qui leurs permettent de survivre longtemps à l'intérieur de vésicule où elles ne sont pas phagocytées par le système immunitaire de l'hôte qu'elles parasitent[3]). Certaines amibes (ex : Hartmannella vermiformis[4]) vivant dans les poumons peuvent abriter des légionelles[4].
Les légionelles ne se multiplient pas en-dessous de 20 °C et sont détruites à partir de 60 °C (en condition de laboratoire).
Conditions nécessaires à une contamination
La présence de légionelles dans l’eau n’est pas une condition suffisante pour provoquer la maladie. Trois facteurs doivent être réunis :
- eau contaminée par Legionella ;
- dispersion de l’eau par aérosols (Ce sont l’eau et ses aérosols qui sont respectivement les lieux de vie et de diffusion via l’air des légionelles. La formation de gouttelettes ou aérosols respirables dans les turbulences ou tourbillons est encore mal comprise[5]), de même qu'en sortie de pommeau de douche[6] ou de robinet[6];
- inhalation de l’aérosol.
Aucun cas de légionellose n’a été diagnostiqué suite à l’ingestion d’eau contaminée, de même qu'aucun cas de transmission interhumaine n'a été signalé. La quantité d'inoculum bactérien ne semble pas influencer le développement de la légionellose. Enfin, des facteurs climatiques ont été incriminés (fortes pluies et humidité, recrudescence des cas en été).
Par ailleurs, des facteurs de susceptibilité liés à l'hôte humain sont requis pour le développement de la maladie, bien qu'incomplètement compris actuellement. Des facteurs de risque sont toutefois individualisables : âge avancé, déficit de l'immunité (cancer/hémopathie, diabète) mais surtout tabagisme. L'infection est exceptionnellement décrite chez l'enfant.
Les taux limites d'alerte sont de 1 000 UFC/litre de Legionella pneumophila pour l'eau chaude sanitaire et 100 000 UFC/litre de Legionella spp (toutes espèces pour les tours aéroréfrigérantes, norme AFNOR NFT 90-431 de septembre 2003).
Dans 90 % des cas, en Occident, la légionellose est due au sérogroupe 1 de l'espèce Legionella pneumophila. Les sérogroupes 2 à 15 se partagent les 10 % restant. Au contraire, en Australie, c'est l'espèce longbeachae qui est responsable de la majorité des cas de légionellose. Il existe enfin 51 autres espèces dans le genre Legionella que l'on appelle couramment Legionella spp et dont le risque infectieux est discuté par les hygiénistes et infectiologues. Cependant la présence de Legionella spp, démontre que les conditions du réseau sont optimales à la multiplication de légionelles et donc potentiellement de Legionella pneumophila.
Écologie des légionelles
Les Legionella sont d'origine hydro-telluriques. Leur habitat naturel est représenté par les milieux aquatiques naturels ou artificiels. Elle y réside, entre autres, dans les biofilms[7],[8] (résidus organiques et micro-organiques formés dans les canalisations et à la surface des eaux stagnantes) qui la protègent de la chloration et semble jouer un rôle important pour sa survie dans les installations[9]. On en trouve y compris dans les biofilms de réseaux d'eau domestiques, parfois associée à Pseudomonas aeruginosa[10]. Outre la nature de l'eau (acidité, minéralisation, teneur en matières organiques et nutriments), la température et le type de matériaux utilisés en plomberie jouent aussi un rôle important dans la formation des biofilms[11],[12].
Le biofilm se développe particulièrement dans :
- tout endroit de stagnation ;
- les bras morts du réseau d'eau chaude ou froide ;
- les ballons de stockage (cumulus) ;
- les points d’eau chaude rarement utilisés (bras mort).
Par ailleurs, les protozoaires d'eau douce (dont les amibes) représentent l'hôte naturel de la légionelle à l'intérieur duquel elle réalise une étape de son cycle de vie. La bactérie et son hôte ont connu une évolution convergente permettant à la bactérie l'acquisition au sein de son patrimoine génétique de gènes codant pour la majeure partie des facteurs de virulence de la légionelle. Le comportement et la virulence[13] des légionelles dans leur environnement microbien est encore mal connu (par exemple celui de leurs capacité à envahir certains protozoaires)[14], et amibes[15] de même que leur environnement lui-même (écosystème des biofilms notamment, interactions avec d’autres espèces, les turbulences de l’eau dans les réseaux, etc). L’ANSES a estimé en 2011 que « le suivi des protozoaires (amibes et ciliés) dans les installations et leur contribution à la dangerosité des installations à risque est trop largement négligé ».
Les risques
Les légionelloses peuvent se manifester sous deux formes cliniques distinctes :
- la « maladie du légionnaire » : pneumopathie sévère, manifestations neurologiques, troubles digestifs, insuffisance rénale nécessitant un traitement antibiotique ;
- la fièvre de Pontiac : syndrome pseudo-grippal bénin à guérison spontanée.
L'infection nosocomiale est incriminée dans 1 à 10 % des cas de pneumopathies nosocomiales.
Que faire pour surveiller le risque des légionelles ?
- Contrôle de la qualité microbiologique de l’eau par un laboratoire accrédité Cofrac (programme 100-2) (il faut savoir également qu'il y a 2 types d'analyses) :
- méthode par culture, après filtration d'un échantillon d'eau : le filtra va être cultivé sur différentes géloses avec plusieurs types de traitement puis elles vont être conservées pendant une dizaine de jours à 37° (méthode normée et réglementaire),
- méthode par PCR : cette méthode va permettre de déceler la legionella par son ADN cette méthode permet d'avoir un résultat dans 24 à 48 H (selon la performance des laboratoire (méthode normée) ;
- entretien hebdomadaire des éléments de robinetterie (mousseurs, brise-jets, flexibles, pommes de douche, etc.) :
- démontage,
- détartrage produit ou vinaigre blanc pendant 15 minutes,
- rinçage,
- désinfection pendant 30 minutes dans l’eau de javel,
- purger régulièrement avec de l’eau la plus chaude possible le maximum de points d’usage ou les points les plus éloignés de l’établissement ;
- bien connaître son réseau d’eau chaude :
- supprimer les bras morts,
- purger les ballons (faire des chasses),
- détartrer les ballons de stockage,
- préférer les échangeurs à plaques.
Que faire si le réseau est infecté ?
Il existe différentes méthodes que le Ministère de la Santé a testé et validé pour les réseaux d'eau potable. Ces méthodes figurent dans la circulaire 2002/243 d'avril 2002. On y trouve notamment :
Le choc au peroxyde d'hydrogène et argent (H2O2+Ag)qui consiste à faire circuler la solution dans l'ensemble du réseau et points contaminés (hors utilisation) à une concentration allant de 100 à 1000 mg/L de peroxyde d'hydrogène + ag pour un temps de contact pouvant aller jusqu'à 12 heures. Àl'issue du temps de contact, on pratique une vidange complète du réseau. L'un des avantages de cette méthode est de détruire le biofilm.
Le choc chloré consiste à obtenir une concentration de chlore libre de 15mg/l pendant 24 h ou de 30 à 50 mg/l pendant 2 à 3 heures au niveau de réservoirs. On pratique une vidange complète du réseau après avoir fait passer l’eau chlorée par le maximum voire par la totalité des points d’usage.
Le choc thermique est pratiqué en élevant la température de l’eau à 70 °C pendant 30 minutes et l’eau doit couler de tous les points d’usage pendant 5 à 10 minutes au minimum à 65 °C.
Les risques liés aux chocs :
- choc H2O2+Ag : Manipulation du produit, ces traitements sont bien souvent réalisés par des professionnels
- choc chloré : corrosion
- choc thermique : risque de brûlure, destruction de la galvanisation des canalisations en acier (dès 60 °C). De plus, certains acteurs ont remarqué un regain de viabilité des L. pneumophila 7 à 10 jours après le traitement par choc thermique. Une hypothèse explicative est « la destruction des Legionella spp. et/ou des flores interférentes qui sont susceptibles de limiter le développement de L. pneumophila par un phénomène de concurrence. La rétention des L. pneumophila dans le biofilm et dans les amibes où elles sont protégées des traitements et l’éradication de la flore libre permet à leur avis une recolonisation spécifique et accrue par L. pneumophila. Ainsi, la présence de concentrations relativement élevées en Legionella spp. pourrait permettre de limiter la prolifération de L.pneumophila et ainsi limiter le risque sanitaire qui y est associé »[16]
La surveillance des légionelles
La loi de santé publique de 2004 visait à réduire le nombre de cas de légionelloses de 50% pour la période 2004-2008, et le second PNSE (plan national santé environnement) vise à mieux investiguer des cas de légionelloses, améliorer la prévention des contaminations des réseaux d'eau chaude sanitaire et poursuite la recherche. Il semblerait logique de suivre les amibes (qui sont a priori indicatrices et facteur de risque), mais il peut y avoir des légionelles sans amibes, et la méthode commune de détection des amibes est coûteuse, longue et tous les laboratoires ne sont pas équipés pour la proposer. Elle n'est donc pas utilisée en routine, mais est utile en cas de sur-contamination post-traitement[16].
La surveillance progresse dont en France[17] où elle est devenue obligatoire pour les eaux minérales à usages thérapeutiques (dans les établissements thermaux), dans les tours aéroréfrigérantes, dans tout réseau d'eau chaude sanitaire d'un établissement de santé ou des établissements sociaux et médico-sociaux, des hôtels, des résidences de tourisme, des campings et des établissements pénitentiaires[18].
Au 1er janvier 2012, cette obligation est étendue aux autres établissements recevant du public (ERP)[18].
La DGS et la DGPR ont reconnu[16] en 2009 que la méthode par culture (obligatoire en France) impose un délai après mise en culture (au moins 8 jours de culture sont nécessaires, bien que des résultats intermédiaires soient possibles en 3 à 5 jours), ce qui nuit à la meilleure gestion des installations et à l'optimisation des délais de levées de mesures restrictives d'usage de l'eau. De plus, elle ne prend pas en compte toutes les formes de Legionella[16], car il existe un certain nombre de légionnelles et autres bactéries viables présentes dans l'eau, mais qu'on ne sait pas cultiver[19].
Un avis[16] et un rapport (2011) d'expertise collective de l'ANSES ont évalué les méthodes de détection et de dénombrement des légionelles dans l'eau, concluant que seules deux méthodes sont « suffisamment pertinentes et robustes » ; la méthode par culture (norme NF T90 431) et (plus rapide[20]) la PCR quantitative (norme NF T 90 471).Il n’existe, à l’heure actuelle, aucun système portable susceptible de réaliser le dénombrement de Legionella).
Il est recommandé de
- Noter toutes les interventions, les opérations de vidange et les analyses
- Mettre à jour les plans du réseau,
- Écrire les procédures d'entretien.
La surveillance bactériologique est obligatoire (en milieu hospitalier souvent réalisée par un technicien biohygiéniste :
- recherche de bactéries aérobies revivifiables : norme < 100/ml ;
- recherche de coliformes totaux : Norme < 10/100 ml ;
- recherche de coliformes fécaux : Norme = Absence dans 100 ml ;
- recherche de staphylocoques pathogènes = Absence dans 100 ml ;
- recherche facultative mais très intéressante de Pseudomonas aeruginosa (indique la dégradation de l’eau, ou la contamination des robinetteries et des surfaces en contact avec de l’eau). Recherche de Pseudomonas aeruginosa obligatoire en établissement de soins ;
- recherche de Légionelles dans l'eau chaude et l'eau froide selon la norme AFNOR NFT 90-431.
En dehors des prélèvements microbiologiques :
- une coupe d’un tuyau et la mise en place d’un manchon témoin peuvent permettre de surveiller la dégradation, la corrosion et la présence de biofilm du réseau ;
- vérifier le cahier des charges et les interventions du prestataire de service chargé de l’installation ;
- identifier les points critiques du réseau ;
- identifier les points critiques de maintenance et la périodicité de cette maintenance ;
- examiner la faisabilité des traitements ;
- définir les points de prélèvements ;
- examiner la possibilité d’isoler des réseaux ;
- essayer de travailler sur une maintenance préventive ;
- préparer un carnet de suivi sanitaire.
Dans les établissements de santé, les procédures concernant le réseau d’eau doivent être validées par le CLIN de l’établissement. En cas d’alerte la direction et le CLIN doivent être prévenus.
La protection
En cas d’intervention technique sur le réseau d’eau, le personnel doit être protégé des éventuelles aérosolisations d’eaux, notamment lorsqu'il travaille sur le réseau d’eau chaude. Port de masque FFP3.
Les gants sont inutiles pour la protection vis-à-vis de la légionelle. La légionellose est une infection strictement respiratoire, il n'existe pas d'infections cutanées à "Legionella".
Bactériologie
Les bactéries du genre Legionella sont des bacilles à Gram négatif (mais rarement visibles à l'examen direct), elles sont mobiles (1 ou 2 flagelles polaires), aérobies strictes, catalase faiblement positive. Leur paroi a la particularité de contenir des acides gras ramifiés insaturés. Ces bactéries sont particulièrement exigeantes et ne peuvent être cultivées que sur milieux spéciaux contenant de la cystéine et du fer comme le milieu CYE (Charbon, Yeast Extract), le milieu GVPC ou le milieu BCYE (Buffered Charcoal Yeast Extract avec cystéine et fer.
Voir aussi
Articles connexes
Liens externes
Blog sur la légionellose:
Bibliographie
Références
- Farhat M, Trouilhe MC, Brand E, Moletta-Denat M, Robine E, Frère J (2010) Development of a pilotscale 1 for Legionella elimination in biofilm in hot water network: heat shock treatment evaluation. Journal of Applied Microbiology 108, 1073-1082
- Kuiper MW, Wullings BA, Akkermans ADL, Beumer RR, Van der Kooij D (2004) Intracellular Proliferation of Legionella pneumophila in Hartmannella vermiformis in Aquatic Biofilms Grown on Plasticized Polyvinyl Chloride. Appl.Environ.Microbiol. 70, 6826-6833
- Bouyer S, Imbert C, Rodier MH, Héchard Y (2007) Long-term survival of Legionella pneumophila associated with Acanthamoeba castellanii vesicles. Environ Microbiol 9, 1341-1344.
- Brieland J, McClain M, LeGendre M, Engleberg C (1997) Intrapulmonary Hartmannella vermiformis: a potential niche for Legionella pneumophila replication in a murine model of legionellosis. Infect.Immun. 65, 4892-4896.
- Baron PA, Willeke K (1986) Respirable droplets from whirlpools: measurements of size distribution and estimation of disease potential. Environ Res 39, 8-18.
- Bollin GE, Plouffe JF, Para MF, Hackman B (1985) Aerosols containing Legionella pneumophila generated by shower heads and hot-water faucets. Applied and Environmental Microbiology 50, 1128- 1131.
- Declerck P (2010) Biofilms: the environmental playground of Legionella pneumophila. Environ Microbiol 12, 557-566.
- Lee HJ, Ho MR, Bhuwan M, Hsu CY, Huang MS, Peng HL, Chang HY (2010) Enhancing ATP-based bacteria and biofilm detection by enzymatic pyrophosphate regeneration. Analytical Biochemistry 399, 168-173
- Murga R, Forster TS, Brown E, Pruckler JM, Fields BS, Donlan RM (2001) Role of biofilms in the survival of Legionella pneumophila in a model potable-water system. Microbiology 147, 3121-3126.
- Moritz MM, Flemming HC, Wingender J (2010) Integration of Pseudomonas aeruginosa and Legionella pneumophila in drinking water biofilms grown on domestic plumbing materials. Int J Hyg Environ Health 213, 190-197.
- Rogers J, Dowsett AB, Dennis PJ, Lee JV, Keevil CW (1994) Influence of temperature and plumbing material selection on biofilm formation and growth of Legionella pneumophila in a model potable water system containing complex microbial flora. Applied and Environmental Microbiology 60, 1585-1592.
- Van der Kooij D, Veenendaal HR, Scheffer WJH (2005) Biofilm formation and multiplication of Legionella in a model warm water system with pipes of copper, stainless steel and cross-linked polyethylene. Water Research 39, 2789-2798
- Barer MR, Smith RJ, Cooney RP, Kimmitt PT (2000) Relationships between culturability, activity and virulence in pathogenic bacteria. J Infect.Chemother. 6, 108-111
- Abu Kwaik Y, Gao LY, Stone BJ, Venkataraman C, Harb OS (1998) Invasion of Protozoa by Legionella pneumophila and Its Role in Bacterial Ecology and Pathogenesis. Appl.Environ.Microbiol. 64, 3127-3133
- Berk SG, Ting RS, Turner GW, Ashburn RJ (1998) Production of Respirable Vesicles Containing Live Legionella pneumophila Cells by Two Acanthamoeba spp. Appl.Environ.Microbiol. 64, 279-286.
- Avis et rapport de l'ANSES sur le dénombrement des légionelles dans l'eau ; Anses, publié : 18 juillet 2011
- Campese C, Bitar D, Jarraud S, Maine C, Forey F, Etienne J, Desenclos JC, Saura C, Che D (2010) ; Progress in the surveillance and control of Legionella infection in France, 1998-2008. Int J Infect.Dis.
- Laurent Radisson, Légionelles dans l'eau : l'Anses recense les méthodes de détection , Bulletin d'Actu-Environnement ; 10 août 2011
- Byrd JJ, Xu HS, Colwell RR (1991) Viable but nonculturable bacteria in drinking water. Appl.Environ.Microbiol. 57, 875-878.
- Ballard AL, Fry NK, Chan L, Surman SB, Lee JV, Harrison TG, Towner KJ (2000) Detection of Legionella pneumophila Using a Real-Time PCR Hybridization Assay. J.Clin.Microbiol. 38, 4215-4218
Catégories :- Bactérie (nom scientifique)
- Gammaproteobacteria
Wikimedia Foundation. 2010.
