- Diagramme de Jablonski
-
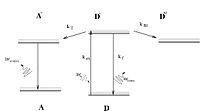 Un diagramme de Jablonski représentant le transfert d'énergie entre molécules fluorescentes.
Un diagramme de Jablonski représentant le transfert d'énergie entre molécules fluorescentes.
Un Diagramme de Jablonski, nommé d'après le physicien polonais Alexandre Jablonski, est un diagramme représentant les états électroniques d'une molécule et les transitions entre ces états. L'axe vertical est un axe en énergie, tandis que les états sont groupés horizontalement selon leur multiplicité de spin. Les transitions radiatives sont symbolisées par des flèches droites tandis que les non-radiatives le sont par des flèches ondulées. L'état vibrationnel fondamental de chaque état électronique est représenté par une ligne épaisse et les autres états vibrationnels par un ligne fine.
Une transition radiative implique l'absorption ou, au contraire, l'émission d'un photon pour passer d'un état à un autre. C'est le cas de la fluorescence et de la phosphorescence. Une transition non-radiative n'implique pas de photons et il existe plusieurs type de mécanismes, symbolisés différemment dans le diagramme. La relaxation d'un état vibrationnel excité vers un état vibrationnel plus stable est appelé R ou vr. Le processus implique la dissipation d'énergie de la molécule vers ses voisines, il est donc interdit pour les molécules isolées. Un second type de transitions non-radiatives est appelé conversion interne (ic), qui se produit quand un état vibrationnel peut se coupler avec un état vibrationnel d'un état de spin de plus basse énergie. Le troisième type de transition, la conversion intersystème (isc pour intersystem crossing), est une transition vers un état de nombre de spin différent. La conversion intersystème est d'autant plus importante que la molécule possède un couplage spin-orbite fort. Ce type de transition non-radiative peut conduire à la phosphorescence.
Voir aussi
Articles connexes
Sources
- (en) Cet article est partiellement issu d’une traduction de l’article de Wikipédia en anglais intitulé « Jablonski diagram ».
Wikimedia Foundation. 2010.
