- Condensation acyloïne
-
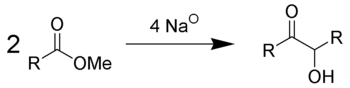
La condensation acyloïne est une réaction réductive de couple entre deux esters carboxyliques, utilisant du sodium métallique et menant à une α-hydroxycétone, ou acyloïne[1],[2],[3].
La réaction a un meilleur taux de réussite si R est aliphatique et inerte. Pour permettre la condensation, la réaction doit se dérouler dans un solvant aprotique avec un point d'ébullition élevé, comme par exemple le benzène ou le toluène. L'utilisation d'un solvant protique mène à une réduction de Bouveault-Blanc des deux esters plutôt qu'une condensation. En fonction toutefois de la taille du cycle et de l'encombrement stérique, mais pas de la dilution, la condensation acyloïne des diesters favorise en général les cyclisations intramoléculaires plutôt que les polymérisations intermoléculaires.

Sommaire
Mécanisme réactionnel
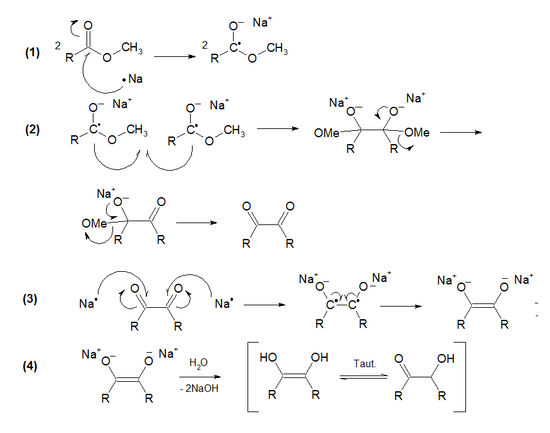
La réaction consiste en quatre étapes :
- (1) ionisation oxydative de deux atomes de sodium sur la double liaison des deux molécules d'ester, les transformant en radicaux
- (2) les radicaux libres des deux molécules se couplent (de type couplage de Würtz) formant un dérivé homolytique des deux esters. Cette formation est suivie de deux éliminations d'alkoxy, une de chaque côté, menant à une 1,2-dicétone.
- (3) à nouveau ionisation oxydative de deux atomes de sodium sur les double liaisons des deux fonctions cétone, avec au final formation d'un énodiolate de sodium .
- (4) neutralisation par l'eau, formant un énodiol, qui se tautomérise ensuite en acyloïne[4].
Variations
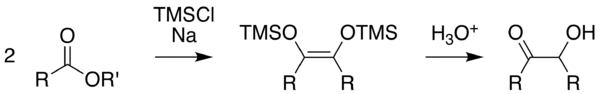
Méthode de Rühlmann
Cette méthode, décrite par K. Rühlmann[5], utilisé du chlorure de triméthylsilyle comme piège chimique, permettant de réduire l'efficacité des réaction en compétition. Cette méthode permet d'accroitre considérablement le rendement. Le clivage hydrolytique du silyléther donne l'acyloïne. Pour permettre un clivage doux, on peut utiliser dans certains cas du méthanol.
On utilise habituellement comme solvants le toluène, le dioxane, le tétrahydrofurane ou des dialkyléthers acycliques. Il a déjà aussi utilisé avantageusement la N-méthyl-morpholine.
Notes et références
- Bouveault, L., and R. Loquin, « Action du sodium sur les éthers des acides monobasiques à fonction simple de la série grasse », dans Comptes. Rendus., vol. 140, 1905, p. 1593–1595 [texte intégral]
- Finley, K. T., « The Acyloin Condensation as a Cyclization Method », dans Chemical Reviews, vol. 64, no 5, 1964, p. 573–589 [lien DOI]
- Bloomfield, J. J.; Owsley, D. C.; Nelke, J. M. ↑ Acyloin condensation [1]
- Rühlmann K., « Die Umsetzung von Carbonsäureestern mit Natrium in Gegenwart von Trimethylchlorsilan », dans Synthesis, no 5, 1971, p. 236–253 [lien DOI]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acyloin condensation » (voir la liste des auteurs)
Voir aussi
- Condensation benzoïne
- Réduction de Bouveault-Blanc
- Condensation de Claisen
- Condensation de Dieckmann
Wikimedia Foundation. 2010.