- Tétrahydrofuranne
-
Tétrahydrofurane
 Cet article concerne la molécule de tétrahydrofurane. Pour la famille des dérivés du tétrahydrofurane, voir oxolane.
Cet article concerne la molécule de tétrahydrofurane. Pour la famille des dérivés du tétrahydrofurane, voir oxolane.Tétrahydrofurane 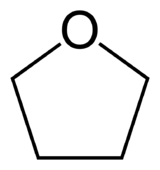
Structure chimique du tétrahydrofurane Général Nom IUPAC Oxacyclopentane Synonymes Oxolane, tétrahydrofurane
THFNo CAS No EINECS PubChem CID 8028 SMILES InChI Apparence liquide incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C4H8O [Isomères] Masse molaire 72,1057 g∙mol-1
C 66,63 %, H 11,18 %, O 22,19 %,Propriétés physiques T° fusion -108,5 °C[1] T° ébullition 66 °C[1] Solubilité dans l'eau : miscible[1] Masse volumique (eau = 1) : 0.89[1] T° d’auto-inflammation 321 °C[1] Point d’éclair -14,5 °C (c.f.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 2-11.8[1] Pression de vapeur saturante à 20 °C : 19.3 kPa[1] Précautions Directive 67/548/EEC 
Xi
FPhrases R : 11, 19, 36/37, Phrases S : 2, 16, 29, 33, [2] Transport - 2056 NFPA 704 SIMDUT[3] 

SGH[4] 

DangerUnités du SI & CNTP, sauf indication contraire. Le tétrahydrofurane (ou 1,4-époxybutane ou oxolane ou oxacyclopentane ou encore oxyde de tétraméthylène), appelé souvent plus simplement THF, est un composé organique hétérocyclique. C'est un des éthers les plus polaires et il est utilisé en synthèse organique comme solvant de polarité moyenne. Il a une température d'ébullition plus grande que la plupart des éthers (Teb = 66 °C). Il est narcotique et toxique (VME 150 mg.m-3). On peut l'obtenir par déshydratation du butan-1,4-diol. Il est difficile de le conserver sec car il est relativement miscible à l'eau.
Purification : élimination des peroxydes dangereux
En outre, il a tendance à former des peroxydes lors du stockage (comme tous les éthers) : il convient donc de tester la présence de peroxydes et le cas échéant de les éliminer avant tout usage car ce sont des composés particulièrement explosifs. Pour cela, on prélève un petit volume de THF à tester et on l'agite avec une solution acidifiée d'iodure de potassium à 10% : si le test est positif (coloration jaune), il faut alors détruire les peroxydes en agitant la totalité du THF avec 1/5 de son volume d'une solution de disulfite de sodium à 5%. On refait le test et l'on recommence si nécessaire le lavage au disulfite de sodium jusqu'à ce que le test soit négatif.
Cette précaution est indispensable avant tout usage du THF et en particulier avant la distillation, opération qui est souvent pratiquée à des fins de purification juste avant l'emploi d'un solvant : en effet, à la fin de la distillation, les résidus seront constitués presque exclusivement de ces peroxydes, lesquels vont s'échauffer et exploser. Une bonne méthode pour éviter ce phénomène est de distiller le THF sous atmosphère inerte (azote ou argon) et sur sodium et benzophénone - (C6H5)2CO -. Celle-ci forme avec le sodium un radical qui réagit avec les peroxydes de THF, l'eau et l'oxygène présents dans le THF et les élimine, produisant ainsi par distillation un THF pur, sec et désoxygéné. De plus le radical, (C6H5)2C∙-O−, possède une belle couleur violet profond qui quand elle est observée, garantit que tous les peroxydes, eau et O2 ont été éliminés.
Liens externes
Notes et références
- ↑ a , b , c , d , e , f , g , h et i TETRAHYDROFURANNE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « tétrahydrofuranne » sur ESIS, consulté le 18 février 2009
- ↑ « Tétrahydrofurane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique irritant | Produit chimique facilement inflammable | Solvant | Oxolane
Wikimedia Foundation. 2010.

