- Trioxyde d'uranium
-
Trioxyde d'uranium 
Général No CAS No EINECS PubChem Apparence poudre jaune orangé Propriétés chimiques Formule brute UO3 Masse molaire[1] 286,0271 ± 0,0009 g·mol-1
O 16,78 %, U 83,22 %,Propriétés physiques T° fusion décomposition : 200-650 °C Masse volumique 6 020 kg·m-3 Précautions 
Composé radioactifDirective 67/548/EEC[2] 
T+
NPhrases R : 26/28, 33, 51/53, Phrases S : (1/2), 20/21, 45, 61, SGH[2] 


DangerUnités du SI & CNTP, sauf indication contraire. Le trioxyde d'uranium, également appelé oxyde d'uranyle ou oxyde d'uranium(VI), est le composé chimique de formule UO3. C'est un solide dont la variété cristalline la plus courante, dite γ-UO3, se présente sous la forme d'une poudre jaune orangé.
Production et utilisation
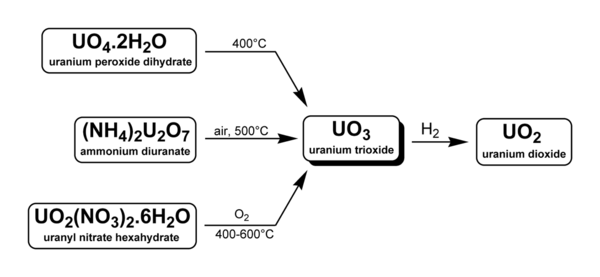
On produit le trioxyde d'uranium à travers trois méthodes, dont deux sont utilisées industriellement dans le retraitement des déchets de centrales nucléaires et dans les procédés d'enrichissement en uranium :
- L'octaoxyde de triuranium U3O8 peut être oxydé à 500 °C par l'oxygène[3]. Mais noter qu'au-dessus de 750 °C, et même sous une pression partielle de 500 kPa d'O2, le trioxyde d'uranium se redécompose en octaoxyde de triuranium U3O8[4]. Le peroxyde d'uranyle UO4•nH2O, avec n compris entre 0 et 4, peut également être réduit en trioxyde d'uranium par chauffage à 400 °C.
- Le diuranate d'ammonium (NH4)2U2O7, ou le diuranate de sodium hexahydraté Na2U2O7•6H2O, des sels de couleur jaune qui constituaient autrefois le yellowcake (et sont à l'origine de ce nom, aujourd'hui assez impropre puis que le yellowcake constitué d'octaoxyde de triuranium est plutôt brun noirâtre), sont convertis en trioxyde d'uranium lors de l'enrichissement de l'uranium. Le dioxyde d'uranium UO2 et le tétrafluorure d'uranium UF4 sont des intermédiaires de ce procédé, qui aboutit à l'hexafluorure d'uranium UF6[5].
- Le nitrate d'uranyle hexahydraté UO2(NO3)2•6H2O peut être chauffé pour donner du trioxyde d'uranium : c'est une réaction utilisée lors du retraitement des déchets nucléaires, qui sont dissous dans de l'acide nitrique HNO3 pour séparer le nitrate d'uranyle du plutonium et des produits de fission. Le nitrate d'uranyle purifié est converti en trioxyde d'uranium solide par chauffage à 400 °C puis réduit par l'hydrogène en présence de gaz inertes pour donner du dioxyde d'uranium UO2 utilisable pour produire des barres de combustible MOX.
Dangerosité du trioxyde d'uranium
Le trioxyde d'uranium présente la même dangerosité que l'uranyle : outre sa nocivité par radioactivité lorsqu'il est enrichi en isotopes radioactifs de l'uranium, UO3 est également chimiquement toxique pour l'organisme et s'accumule dans les tissus où il altère les chromosomes jusqu'à provoquer des cancers et des affections congénitales lorsqu'il atteint les gamètes.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Uranium compounds » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 septembre 2011 (JavaScript nécessaire)
- Sheft I, Fried S, Davidson N, « Preparation of Uranium Trioxide », dans Journal of the American Chemical Society, vol. 72, 1950, p. 2172–2173 [lien DOI]
- Wheeler VJ, Dell RM, Wait E, « Uranium trioxide and the UO3 hydrates », dans J. Inorganic Nuclear Chemistry, vol. 26, 1964, p. 1829–1845 [lien DOI]
- Dell RM, Wheeler VJ, « Chemical Reactivity of Uranium Trioxide Part 1. — Conversion to U3O8, UO2 and UF4 », dans Transactions of the Faraday Society, vol. 58, 1962, p. 1590–1607 [lien DOI]
Catégories :- Composé de l'uranium
- Produit chimique très toxique
- Produit chimique dangereux pour l'environnement
- Oxyde
- Matériau nucléaire
Wikimedia Foundation. 2010.