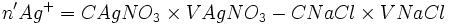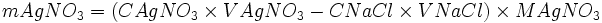- Titreur
-
Titrage
 Montage d'un titrage
Montage d'un titrageLa titrimétrie ou titrage est une technique de dosage utilisée en chimie analytique afin de déterminer la concentration d'une espèce chimique en solution (ou titre d'une solution).
La méthode de titrage la plus utilisée est la volumétrie ou titrage volumétrique. Elle consiste à utiliser une solution de concentration connue (appelée titrant) afin de neutraliser une espèce contenue dans la solution inconnue.
Les titrages volumétriques les plus répandus sont les titrages acide-base : L'opérateur fait couler goutte à goutte un acide dans un volume déterminé de base. Ainsi les réactifs réagissent mol à mol. Le titrage base-acide est aussi possible.
Le point de neutralisation est connu grâce à un indicateur coloré ajouté dans la solution inconnue (Cet indicateur change de couleur au moment de la neutralisation) ou grâce à une variation du potentiel ou du pH (mesuré au moyen d'une électrode trempant dans la solution inconnue).
Sommaire
Matériel nécessaire
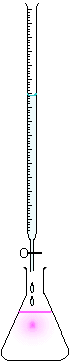 Montage pour faire un titrage. La burette contient une solution titrante, et l'erlen la solution à titrer
Montage pour faire un titrage. La burette contient une solution titrante, et l'erlen la solution à titrer
On utilise en général une burette graduée quand le titrage est manuel ou un titrimètre automatique quand on souhaite améliorer la répétabilité et la traçabilité. Le volume de l'échantillon est prélevé au moyen d'une pipette de volume déterminé et est placé dans un erlenmeyer. La burette contient toujours la solution de réactif titrante dont on connaît la concentration. La burette donne le volume versé de solution titrante et donc nous donnera le point à l'équivalence. La solution à doser sera toujours dans un becher ou autre récipient propre, elle sera en volume exactement connu.
Titrage en solution aqueuse
Pour réaliser un titrage, on réalise une réaction chimique où l'espèce en solution réagit avec une autre substance. L'espèce à doser est appelée réactif titré et la substance ajoutée est appelée réactif titrant
Il est possible de réaliser un titrage conductimétrique (pour une réaction acido-basique), un titrage colorimétrique, un titrage pH-métrique, ...
Les titrages pH-métrique
 Dosage d'un acide fort par une base faible en présence d'un indicateur coloré.
Dosage d'un acide fort par une base faible en présence d'un indicateur coloré.
Ce type de titrage est réalisable uniquement avec des acides et des bases, faible ou fort, et sous présence d'un PH-mètre ou d'un indicateur de pH colorée.
Titrage d'un acide fort par une base forte
En solution, les acides forts comme l'acide chlorhydrique sont totalement dissociés et donnent des ions
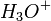 . De même, les bases fortes se dissocient totalement pour libérer des ions
. De même, les bases fortes se dissocient totalement pour libérer des ions 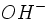 . Les ions
. Les ions 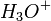 et
et 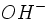 réagissent de la façon suivante:
réagissent de la façon suivante: 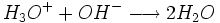 (Voici l'équation générale de neutralisation)
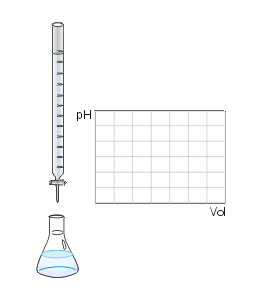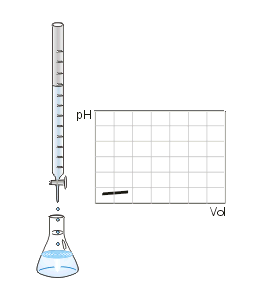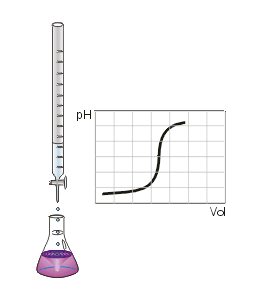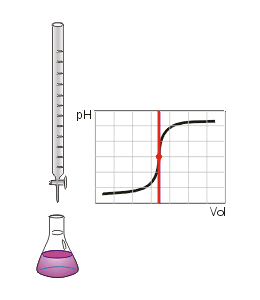
(Voici l'équation générale de neutralisation)Au volume à l'équivalence tous les ions H3O + et OH − ont réagit, la seule réaction qui se produit est celle de l'autoprotolyse de l'eau. Le pH est alors égal à 7. L'équivalence est indiquée soit par un indicateur de pH, soit indirectement par une courbe représentant le pH en fonction du volume de base versé. Vous devez pour cela relever les valeurs du PH-mètre pour chaque mL de solution versée. Quand le pH commence à augmenter de façon significative, versez alors 0,2 ml de solution entre chaque mesure de pH une fois que le pH sera redevenu relativement stable reprenez une mesure de pH tous les ml En traçant la courbe du pH en fonction du volume de base versée, ont obtient la courbe représentée comme sur le dessin animé. Pour retrouver le volume à l'équivalence, vous devez tracer les tangentes aux deux points d'inflexion ( là où la courbe change de direction). Les tangentes doivent être parallèles. Tracer une perpendiculaire à ces deux droites, puis grâce à un compas, tracer la médiatrice de la perpendiculaire. La médiatrice doit être parallèle aux tangentes . Le volume à l'équivalence est l'endroit où la médiatrice et la courbe se rencontrent, pour un pH de 7 .
Les titrages par indicateurs colorés
Article détaillé : titrage par indicateurs colorés.Les titrages conductimétriques
Un titrage conductimétrique utilise la capacité des ions à conduire le courant électrique dans un milieu aqueux, on mesure alors la conductance de la solution grâce à une électrode. Comme chaque ion conduit le courant différemment, la conductance varie pendant le dosage. Cette notion est directement liée avec la concentration des ions présents. Par exemple : L'ion H3O + conduit mieux le courant que l'ion OH − . Si vous faites réagir les ions H3O + , la conductance de la solution va baisser car ces ions disparaissent ( la concentration des ions H3O + diminue ) .Puis si vous continuez le titrage au-delà du point a l'équivalence, la conductance va monter, car les ions OH − seront de plus en plus nombreux,(la concentration des ions OH − augmente). En relevant les valeurs indiquées par le conductimètre, on peut tracer la droite de la conductance en fonction du volume versé. Il se dessine alors deux droites adjacentes, en forme de V.Le point adjacent indique le volume à l'équivalence.
Calculs
Le but d'un titrage est de trouver la concentration en un élément donné. Il existe pour cela deux moyens possibles : par le calcul et par un tableau d'avancement. Dans les deux cas il faut connaître l'équation bilan de la réaction.
Méthode mathématique
A l'équivalence, on a
- Donc
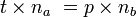
- D'où
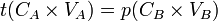
- donc
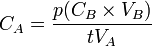
Avec :
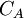 : concentration de la solution connue en mol.L-1(titrant)
: concentration de la solution connue en mol.L-1(titrant)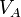 : volume de titrant coulé en litres (L)
: volume de titrant coulé en litres (L)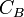 : concentration de la solution inconnue en mol.L-1
: concentration de la solution inconnue en mol.L-1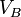 : volume d'échantillon utilisé en litres (L)
: volume d'échantillon utilisé en litres (L)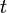 et
et 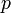 : coefficents stoechiométriques
: coefficents stoechiométriques
Cette formule est générale quels que soient les coefficients (ou nombres) stoechiométriques.
En raisonnant avec les concentrations alors les coefficients stoechiométriques interviennent.
Tableau d'avancement
Le bilan de la réaction s'écrit comme ceci :
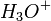
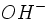
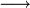
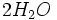
Etat initial 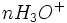
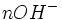
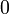
Etat intermédiaire 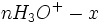
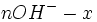
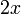
Etat Final 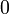
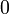
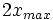
Au début du titrage, (quand vous n'avez encore rien versé), vous n'avez que des réactifs et aucun produit de réaction. Au fur et à mesure que votre réaction se déroule, une quantité x de réactif disparaît, alors qu'en même temps une quantité x de produit apparaît. C'est l'application de la loi de lavoisier. A la fin du titrage, c'est-à-dire quand un de vos réactifs a totalement disparu (celui se trouvant dans votre erlen) vous avez atteint l'avancement maximal, votre réaction ne peut pas aller plus loin.
A ce moment là
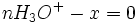
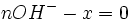
- donc
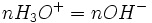
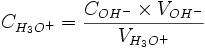
Ce tableau permet de comprendre ce qui ce passe pendant la réaction et de ne pas vous tromper avec les coefficients. En effet vous avez juste à les reporter devant le X . Normalement quand vous avez de l'eau dans votre réaction vous devez écrire "en excès" (vous avez toujours plus d'eau qu'il n'en faut pour que la réaction se déroule)
Calcul d'un excès
Au départ la solution titrée est en excès. Après l'équivalence, c'est la solution titrante qui est en excès. Pour une réaction acido-basique, l'acide est limitant au début et pour une oxydo-réduction, c'est l'oxydant qui est limitant avant l'équivalence.
Un excès est une partie des réactifs qui ne réagit pas pendant une réaction chimique et qui se retrouve donc dans les produits de la réaction. On peut doser l'excès de réactif avec une deuxième réaction chimique : c'est un dosage en retour.
Rappels
- Le nombre de mole
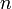 correspond à la quantité de matière d'une espèce chimique.
correspond à la quantité de matière d'une espèce chimique. - La masse molaire
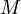 d'un élément est la quantité de matière qu'il faut pour avoir une mole de cet élement. Exemple :
d'un élément est la quantité de matière qu'il faut pour avoir une mole de cet élement. Exemple : 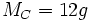 , il faut 12 grammes de carbone pour avoir 1 mole.
, il faut 12 grammes de carbone pour avoir 1 mole. - La masse
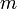 est la quantité de matière pesée.
est la quantité de matière pesée.
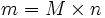
- La concentration
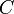 est la quantité de matière contenue dans un litre de solution. Elle est exprimée en mol/L ou en g/L.
est la quantité de matière contenue dans un litre de solution. Elle est exprimée en mol/L ou en g/L.
C = n / V ou C = m / V
Exemple de calcul
On fait réagir du chlorure de sodium NaCl avec du nitrate d'argent AgNO3.
On verse 10 ml de NaCl à 0.2 mol/L dans un becher contenant 20 ml de AgNO3 à 0.2 mol/L.
- M Ag =47 g/mol
- M N = 14 g/mol
- M O = 16 g/mol
Déterminer la masse de l'excès d'AgNO3.
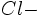
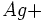
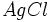
Etat initial 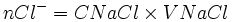
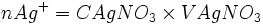
0 Etat intermédiaire 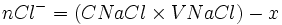
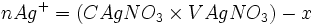
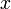
Etat final 0 
xmax - nCl − − xmax = 0
- xmax = nCl −
- nAg + − xmax = n'Ag +
- nAg + − nCl − = n'Ag +
Bibliographie
- L. Lopes, « Réactions "totales" en solution aqueuse », dans Bulletin de l’union des physiciens, vol. 99, no 872(1), Mars 2005, p. 385-396 [texte intégral]
Liens externes
- Critère de réaction totale - Application aux dosages
- Titrages pH-métriques - résolution ou simulation avec Excel, en anglais ou portugais
- Graphe de Gran: linéarisation graphique permettant la détermination du point d'équivalence, du pKW (ou pKa) et autres paramètres
- Portail de la chimie
Catégories : Chimie analytique | Technique de laboratoire
Wikimedia Foundation. 2010.