- Tampon (chimie)
-
Solution tampon
 Pour les articles homonymes, voir tampon.
Pour les articles homonymes, voir tampon.En chimie, une solution tampon est une solution qui maintient approximativement le même pH malgré l'addition de petites quantités d'un acide, d'une base ou d'une dilution. Si l'un de ces trois critères n'est pas vérifié alors la solution est un pseudo-tampon.
En général les tampons sont composés d'un acide faible et de sa base conjuguée, par exemple une solution de NH4+ et de NH3. On trouve dans le sang humain un tampon d'acide carbonique (H2CO3) et de hydrogénocarbonate (HCO3-) qui maintient le pH entre 7,35 et 7,45.
Le pouvoir tampon maximal d'une solution est obtenu pour un mélange équimolaire. Dans ce cas le pH est égal à la valeur du pKa du couple en solution. ( Car pH = pKa + log([base]/[acide]) (relation de Henderson-Hasselbalch) ; or ici [base]=[acide] ; d'où pH = pKa ) Plus la solution tampon est concentrée, plus son pouvoir tampon est important.
Il existe également des tampons redox qui vont fixer approximativement le potentiel des solutions et des tampons ioniques qui vont fixer approximativement la force ionique des solutions.
Le pH d'une solution tampon
Le pH est maintenu constant grâce à l'absorption ou à la libération d'un ion H+ par les espèces en présence dans la solution.
Par exemple l'acide acétique (qui est un des constituants du vinaigre) donne :
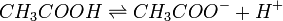
Cette réaction est réversible et en équilibre. Lorsqu'un composé de ce type est présent dans une solution, les deux espèces moléculaires CH3COOH et CH3COO- sont donc présentes. Ainsi, si vous ajoutez par exemple un acide à cette solution, une partie de ceux ci vont être consommés dans la réaction suivante :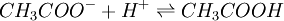
La proportion de molécules CH3COO- et CH3COOH va donc être modifiée, mais le pH quant à lui variera beaucoup moins que si ces molécules n'étaient pas présentes dans l'eau.
C'est ce que l'on appelle "l'effet tampon".
Aspects mathématiques
- Evolution du pH
On prendra dans un premier temps la définition du ph tel que donnée dans la relation d'henderson-hesselbach.On considère donc que ph=pka + log(A / AH). A represente la quantité de base, AH l'acide.Après la réaction chimique, il y aura donc x produit et 1-x réactif.Autrement dit en faisant réagir l' acide A avec une base je vais entrainer la formation de x base du couple acido/basique correspondant.Il me restera que 1-x acide A. Notre équation devient ph = pka + log(x / (1 − x)). Il faut étudier les variations de la fonctions ph en fonction de x c'est à dire de l'espèce chimique réactive apportée ( cela peut être de la soude ou tout autre base forte). Il faut donc dériver cette première expression et l'on trouve que ph' = 1 / ln(10) * 1 / (x(1 − x)).Le maximum de cette fonction dérivée nous donnera la quantité x où ph=pka,caractéristique des solutions tampons. Pour donc trouver quel est le "x" maximum de la fonction ph' il nous faut la dériver une nouvelle fois.Cela donne ph"=(1/ln(10))*(2x-1)/(x²(1-x²)). Résolvons ph"=0; cela donne x =0.5.Il faut donc apporter une demi fois de moins de base que d'acide pour réaliser une solution tampon.
- Pouvoir tampon
Le pouvoir tampon est la fonction qui montre la capacité de résistance de la solution tampon à des élements perturbateurs. On définit ce pouvoir tampon comme étant la fonction PT=dY / dph.Le but du jeu est de la rendre maximale,tel que l'on apporte le maximum d'élément perturbateur "y" à la solution pour une variation minime du ph. Nous sommes dans le cas où le système est formé.On a donc A=AH.On désignera cette quantité sous la variable C. On reprend donc la relation initiale,ph=pka+log(A-y)/(AH+y).En dérivant cette expression on obtient ph'=1/ln(10)*(2C)/(C²-y²) .On a posé que le pouvoir tampon est l' inverse de la dérivée effectuée précedemment. On obtient Pouvoir Tampon =ln(10)*(C²-Y²)/(2C) Pour trouver le maximum de Pouvoir Tampon il faut dériver la fonction "PT" et résoudre PT'=0. On peut observer que le pouvoir tampon est maximal quand on ajoute aucune entité perturbatrice donc pour y=0. Ainsi obtient t-on PTmax=(ln(10) / 2) * c.
Voir aussi
- Portail de la chimie
Catégories : Solution | Acide | Base | Ion | Chimie des solutions
Wikimedia Foundation. 2010.
