- Reduction de Wolff-Kishner
-
Réduction de Wolff-Kishner
En chimie organique, la réduction de Wolff-Kishner est le nom donné à la réaction permettant de convertir le groupement carbonyle en groupement CH2 à l'aide d'hydrazine en milieu acide suivi d'un traitement en milieu basique (soude) :
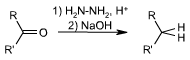
Cependant la seconde partie de la réduction est réalisée généralement dans le glycol (ethane-1,2-diol) à haute température, typiquement, 180 °C. Cela rend la méthode Wolff-Kishner intéressante pour des molécules relativement thermorésistante. De même il faut que la molécule tolère bien les milieux basiques. Si ce n'est pas le cas, la réduction de Clemmensen se déroule en milieu acide et constitue une alternative à la réduction de Wolff-Kishner. Enfin, il existe encore une méthode de réduction qui passe par les thioacétals suivit d'une réduction par H2 sur métal noble (Ni, Pt, Pd).Mécanisme
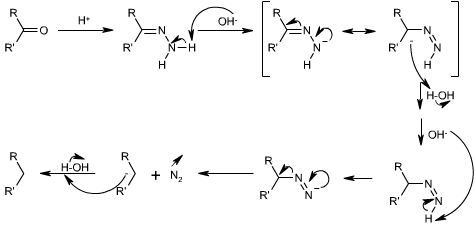
En présence d'ions H+, la cétone est convertie en hydrazone, il se forme une imine. Le traitement à l'aide de soude va alors permettre d'arracher un des protons, acide, lié à l'atome d'azote. La charge négative va alors être transférée, par mésomérie, sur l'atome de carbone qui va pouvoir arracher un proton à une molécule d'eau. Ce processus va alors recommencer, et lors du transfert de la charge négative de l'azote vers le carbone, une molécule de diazote va être libérée, rendant cette réaction irréversible. La capture d'un proton par l'anion conduit finalement au groupement CH2 attendu.
Références
- Kishner, N.J. Russ. Phys. Chem. Soc., 43, 582 (1911).
- Wolff, L. Ann., 1912, 394, 86.
- Portail de la chimie
Catégories : Réaction d'oxydo-réduction organique | Hydrazine
Wikimedia Foundation. 2010.
