Na2SiO3
- Na2SiO3
-
Silicate de sodium
| Silicate de sodium |
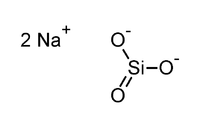 |
| Général |
| Synonymes |
Métasilicate de disodium
Sel sodique de l'acide silicique
|
| No CAS |
6834-92-0 |
| No EINECS |
229-912-9 |
| No E |
E550 |
| Apparence |
solide de formes variables incolore a blanc,hygroscopique.[1] |
| Propriétés chimiques |
| Formule brute |
Na2O3SiNa2SiO3 |
| Masse molaire |
122,0632 g∙mol-1
Na 37,67 %, O 39,32 %, Si 23,01 %,
|
| Propriétés physiques |
| T° fusion |
1 089 °C[1],
72 °C (pentahydrate),
48 °C (nonahydrate) |
| Solubilité |
175 g/l dans l'eau à 20 °C |
| Masse volumique |
2.6 g/cm³[1] |
| Thermochimie |
| S0solide |
113.8 J.K-1.mol |
| ΔfH0solide |
-1519 kJ/mol |
| Précautions |
|
Directive 67/548/EEC
|

C
|
|
Numéro index :
014-010-00-8
Classification :
C; R34 - Xi; R37
Symboles :
C : Corrosif
Phrases R :
R34 : Provoque des brûlures.
R37 : Irritant pour les voies respiratoires.
Phrases S :
S13 : Conserver à l’ écart des aliments et boissons, y compris ceux pour animaux.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
(S1/2) : Conserver sous clef et hors de portée des enfants.
S24/25 : Éviter le contact avec la peau et les yeux.
S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/ du visage.
|
| Phrases R : 34, 37, |
| Phrases S : (1/2), 13, 24/25, 36/37/39, 45, |
|
Transport
|
Code Kemler :
80 : matière corrosive ou présentant un degré mineur de corrosivité
Numéro ONU :
3253 : TRIOXOSILICATE DE DISODIUM
Classe :
8
Étiquette :

8 : Matières corrosives
Emballage :
Groupe d'emballage III : matières faiblement dangereuses.
|
|
SIMDUT[2]
|
 E,
E,
E : Matière corrosive
nécrose de la peau chez l'animal
Divulgation à 1,0% selon la liste de divulgation des ingrédients
|
|
SGH[3]
|

Danger
H314, H335,
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H335 : Peut irriter les voies respiratoires
|
|
Unités du SI & CNTP, sauf indication contraire.
|
Le silicate de sodium est un solide blanc de formule Na2SiO3 qui se forme naturellement par réaction de la silice avec le carbonate de sodium.
Références
 Portail de la chimie
Portail de la chimie
Catégories : Composé du sodium | Composé du silicium | Produit chimique corrosif | Silicate
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Na2SiO3 de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Натриум силицикум - Natrium silicicum, Натрия силикат — Na2SiO3 натрия силикат. Получается взаимодействием, сплавлением карбоната натрия с кремнеземом. Кристаллическое вещество, хорошо растворимое в воде.В гомеопатии используется химически чистый силикат натрия, полученный на химических заводах.… … Справочник по гомеопатии
Sodium silicate — E550 redirects here. For the Italian locomotive, see FS Class E550 Sodium silicate … Wikipedia
Метасиликат натрия — Метасиликат натрия … Википедия
Silicate de sodium — Formule, et échantillon de silicate de … Wikipédia en Français
Силикаты (соли) — У этого термина существуют и другие значения, см. Силикаты. Силикаты (от лат. silex камень) соли метакремниевой кислоты H2SiO3, например, стеклом. В природе встречается в виде минералов, а также являются основой горных пород, из которых состоит… … Википедия
НАТРИЯ СИЛИКАТЫ — соли к т кремния. Бесцв. кристаллы или стеклообразные в ва. Известны: метасиликат Na2SiO3, ортосиликат Na4SiO4, пиросиликат Na6Si2O7, a также пентаоксодисиликат Na2Si2O5, октаоксотрисиликат Na4Si3O8, гептаоксотрисиликат Na2SiO3, октасиликат… … Химическая энциклопедия
Mineralizer — The purpose of a mineralizer is to facilitate the transport of insoluble “nutrient” to a seed crystal by means of a reversible chemical reaction. Overtime, the seed crystal accumulates the material that was once in the nutrient and grows.… … Wikipedia
Silicon dioxide — Silica redirects here. For other uses, see Silica (disambiguation). Silicon dioxide … Wikipedia
Sodium oxide — Sodium oxide … Wikipedia
КРЕМНИЙ — Si (silicium) химический элемент IVA подгруппы (C, Si, Ge, Sn и Pb) периодической системы элементов, неметалл. Кремний в свободном виде был выделен в 1811 Ж.Гей Люссаком и Л.Тенаром при пропускании паров фторида кремния над металлическим калием,… … Энциклопедия Кольера





