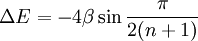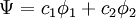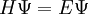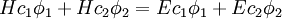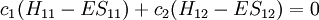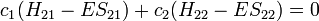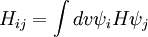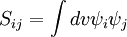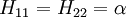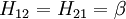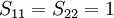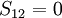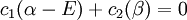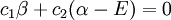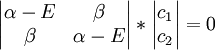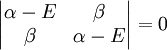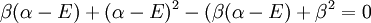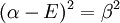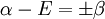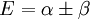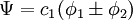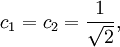- Méthode De Hückel
-
Méthode de Hückel
La méthode de Hückel ou méthode d'orbitales moléculaires de Hückel (HMO pour Hückel molecular orbital method), proposée par Erich Hückel en 1930, est une méthode de CLOA pour déterminer les énergies des orbitales moléculaires des électrons π dans les systèmes d'hydrocarbures conjugués, comme l'éthylène, le benzène ou encore le buta-1,3-diène[1],[2]. Elle constitue la base théorique de la règle de Hückel; la méthode de Hückel étendue développée par Roald Hoffmann est elle la base des règles de Woodwar-Hoffmann[3]. Elle a été plus tard étendue à des molécules conjuguées comme la pyridine, le pyrrole et le furane contenant des atomes autres que le carbone, dénommés dans ce contexte comme hétéroatomes[4].
Cette méthode constitue un excellent outil pédagogique pour l'introduction à la chimie théorique et figure en tant que tel dans de nombreux ouvrages.Sommaire
Caractéristiques de la méthode
Cette méthode possède plusieurs caractéristiques :
- elle se restreint aux hydrocarbures conjugués.
- seules les orbitales moléculaires à électrons π sont prises en compte car elles déterminent les propriétés générales de ces molécules, et les électrons σ sont ignorés. Cette caractéristique est basée sur la séparabilité σ-π.
- elle se base sur la méthode CLOA, sur l'équation de Schrödinger et sur les simplifications provenant de considérations sur les symétries d'orbitales. Elle n'utilise - de manière intéressante - aucune constante physique.
- elle prédit le nombre de niveaux d'énergie pour une molécule donnée, lesquels sont dégénérés, et exprime les énergies des orbitales moléculaires comme une somme de deux autres termes d'énergie appelés α, pour l'énergie d'un électron dans une orbitale 2p, et β, énergie d'interaction entre deux orbitales p, qui sont inconnus mais qui deviennent indépendants de la molécule considérée. Elle permet aussi le calcul de la densité de charge pour chaque atome dans le cadre pi, l'ordre de liaison pour n'importe quelle paire d'atomes et le moment dipolaire moléculaire total.
Résultats de la méthode
Quelques résultats pour des molécules simples sont tabulés ci-dessous.
Molécule Énergie Orbitale frontière Différence d'énergie HO - BV Éthylène E1 = α - β BV -2β E2 = α + β HO Buta-1,3-diène E1 = α + 1,62β E2 = α + 0,62β HO -1,24β E3 = α - 0,62β BV E4 = α - 1,62β Benzène E1 = α + 2β E2 = α + β E3 = α + β HO -2β E4 = α - β BV E5 = α - β E6 = α + 2β Cyclobutadiène E1 = α + 2β E2 = α HO 0 E3 = α HO E4 = α - 2β Tableau 1. Résultats de la méthode de Hückel
Les deux énergies les plus basses sur les α et β du haut sont toutes deux négatives[5].La théorie prédit deux niveaux d'énergie pour l'éthylène, avec deux électrons π remplissant l'orbitale HO de basse énergie et l'orbitale BV d'haute énergie reste vide. Dans le butadiène, les quatre électrons π occupent deux orbitales moléculaires de basses énergies sur un total de quatre et pour le benzène, six niveaux d'énergies sont prédits dont deux dégénérés.
Pour les systèmes linéaires et cycliques (avec n atomes), des solutions générales existent[6].Linéaire:
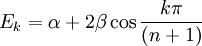
Cyclique:
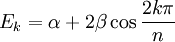
De nombreuses prédictions ont été expérimentalement vérifiées :
- l'espacement (gap) HO-BV exprimé en termes de constante β est corrélé directement avec les transitions électroniques moléculaires observées en spectroscopie ultraviolet-visible. Pour les polyènes linéaires, les différences d'énergies sont données par :
- les énergies des orbitales moléculaires prédites sont indiquées par le théorème de Koopmans corrélé avec la spectroscopie photoélectronique[8].
- l'énergie de délocalisation de Hückel est corrélée avec l'enthalpie de combustion. Cette énergie est définie comme la différence entre l'énergie π totale prédite (dans le benzène, 8β) et une énergie π hypothétique pour laquelle toutes les unités éthylène sont considérées comme isolées et contribuant chacune pour 2β (soit pour le benzène, 3×2 = 6β).
- les molécules avec des orbitales couplées telles que seul leur signe diffère (par exemple α+/-β) sont appelés hydrocarbures alternés et ont en commun de faibles moments dipolaires. Ils contrastent avec les hydrocarbures non-alternés comme l'azulène ou le fulvène avec de forts moments. Le modèle de Hückel est plus précise pour les hydrocarbures alternés.
- pour le cyclobutadiène, le modèle prédit que les deux électrons de haute énergie occupent une paire dégénérée d'orbitales moléculaires qui ne sont ni stables, ni instables. Ainsi, la molécule carrée serait un diradical triplet très réactif (l'état fondamental est en réalité rectangulaire sans orbitales dégénérées). En fait, tous les hydrocarbures cycliques conjugués avec un total de 4n électrons π montrent ce type d'orbitales moléculaires et forment une base de la règle de Hückel.
Quelques mathématiques utilisées dans la méthode de Hückel
La méthode de Hückel peut être dérivé de la méthode de Ritz avec quelques postulats supplémentaires concernant la matrice de recouvrement S et la matrice de Hamilton H.
Il est donc postulé que la matrice de recouvrement S est la matrice identité. Ceci signifie que le recouvrement des orbitales est négligé et que les orbitales sont considérées comme orthogonales. Donc le problème des valeurs propres généralisées de la méthode de Ritz devient un problème simple de valeurs propres.
La matrice de Hamilton H = (Hij) est paramétrée de la manière suivante :- Hii = α pour les atomes de carbone et α + hA β pour les autres atomes A.
- Hij = β si les deux atomes sont liés et tous deux des atomes C, et kAB β pour les autres atomes voisins A et B.
- Hij =0 dans tous les autres cas.
Les orbitales sont les vecteurs propres et les énergies les énergies propres de la matrice hamiltonienne. Si le composé est un hydrocarbure pur, le problème peut être résolu sans autre connaissance sur les paramètres. Pour les systèmes hétéroatomiques, comme la pyridine, des valeurs de hA et kAB doivent être spécifiés.
Exemple de l'éthène
Dans le traitement selon Hückel de l'éthylène[9], l'orbitale moléculaire
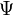 est une combinaison linéaire des orbitales atomiques 2p
est une combinaison linéaire des orbitales atomiques 2p 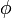 des atomes de carbone avec les coefficients
des atomes de carbone avec les coefficients  :
:Cette équation est alors introduite dans l'équation de Schrödinger :
où
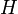 est le hamiltonien et
est le hamiltonien et 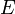 l'énergie correspondant à l'orbitale moléculaire.
l'énergie correspondant à l'orbitale moléculaire.L'équation est alors multipliée par
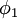 (puis par
(puis par 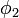 ) et intégrée afin de donner l'ensemble d'équations :
) et intégrée afin de donner l'ensemble d'équations :où :
Les hamiltoniens entièrement diagonaux
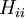 sont appelés intégrales de Coulomb et ceux de type
sont appelés intégrales de Coulomb et ceux de type 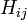 où les atomes i et j sont liés des intégrales de résonance avec les relations suivantes :
où les atomes i et j sont liés des intégrales de résonance avec les relations suivantes :Un autre des postulats sont que l'intégrale de recouvrement entre deux orbitales atomiques est nulle :
Ceci conduit à deux équations homogènes :
avec un total de cinq variables. Après avoir converti cet ensemble en notation maticielle:
La solution triviale fournit les deux coefficients des fonctions d'ondes c égaux à zéro, ce qui n'est pas extrêmement utile pour la résolution. L'autre solution non triviale est :
qui peut être résolue en développant son déterminant:
ou
et
Après normalisation, les coefficients sont obtenus :
La constante β dans le terme d'énergie est négatif et ainsi α + β est l'énergie la plus basse, correspondant à l'orbitale la plus haute occupée (HO) et α - β à la plus basse vacante (BV).
Références
- ↑ E. Hückel, Zeitschrift für Physik, 70, 204, (1931); 72, 310, (1931); 76, 628 (1932); 83, 632, (1933)
- ↑ Hückel Theory for Organic Chemists, C. A. Coulson, B. O'Leary and R. B. Mallion, Academic Press,1978.
- ↑ Stereochemistry of Electrocyclic Reactions R. B. Woodward, Roald Hoffmann J. Am. Chem. Soc.; 1965; 87(2); 395-397. DOI:10.1021/ja01080a054
- ↑ Andrew Streitwieser, Molecular Orbital Theory for Organic Chemists, Wiley, New York, (1961).
- ↑ The chemical bond 2nd Ed. J.N. Murrel, S.F.A. Kettle, J.M. Tedder ISBN 0471907600)
- ↑ Quantum Mechanics for Organic Chemists. Zimmmerman, H., Academic Press, New York, 1975.
- ↑ Use of Huckel Molecular Orbital Theory in Interpreting the Visible Spectra of Polymethine Dyes: An Undergraduate Physical Chemistry Experiment. Bahnick, Donald A. J. Chem. Educ. 1994, 71, 171
- ↑ Huckel theory and photoelectron spectroscopy. von Nagy-Felsobuki, Ellak I. J. Chem. Educ. 1989, 66, 821.
- ↑ Quantum chemistry workbook Jean-Louis Calais ISBN 0471594350
Pour approfondir
- (en) The HMO-Model and its applications: Basis and Manipulation, E. Heilbronner and H. Bock, English translation, 1976, Verlag Chemie.
- (en) The HMO-Model and its applications: Problems with Solutions, E. Heilbronner and H. Bock, English translation, 1976, Verlag Chemie.
- (en) The HMO-Model and its applications: Tables of Hückel Molecular Orbitals , E. Heilbronner and H. Bock, English translation, 1976, Verlag Chemie.
Lien externe
(en) Hückel method
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Hückel method ».
- Portail de la chimie
Catégorie : Chimie théorique
Wikimedia Foundation. 2010.