- Cytoglobine
-
La cytoglobine (ou histoglobine) est une globine respiratoire constituée, chez l'homme et la souris, par 190 acides aminés. Elle est produite par le gène (CYGB), localisé dans sur le chromosome 17q25. contrairement à d'autres globines tissu-spécifiques (hémoglobine produite par les globules rouges, myoglobine dans les muscles, neuroglobine dans le système nerveux), elle semble ubiquitaire c’est-à-dire exprimée dans la totalité des types cellulaires de l'organisme[1].
Sommaire
Le gène de la cytoglobine
L'étude phylogénétique des gènes des globines montre que la cytoglobine et la myoglobine appartiennent à un même clade distinct de celui de l'hémoglobine et la neuroglobine. La globine ancestrale qui leur a donné naissance remonte à plus de 450 millions d'années.
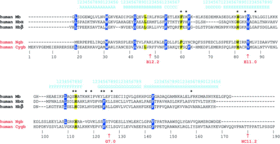
La cytoglobine mammalienne affiche une longueur plus importante (190 amino acides) que celles d'autres globines (140 et 150 amino acides). Ceci est dû à une extension de deux vingtaines d'amino acides aux extrémités N et C terminales de la protéine. En effet la cytoglobine se replie en huit hélices de type α. Les résidus impliqués chez les globines dans la fixation de l'oxygène sont conservés aussi pour la cytoglobine. En plus des deux introns B12.2 et G7.0 contenus dans les gènes d'autres globines (hélices B et G), celui de la neuroglobine (CYGB) comporte un troisième intron HC11.2 dans l'hélice H près de l'extrémité 3’ de la région codante. Ce dernier exon du côté 3’ est absent chez les poissons mais s'acquiert plus tard dans l'évolution des tétrapodes[1].
L'expression et la fonction de la cytoglobine
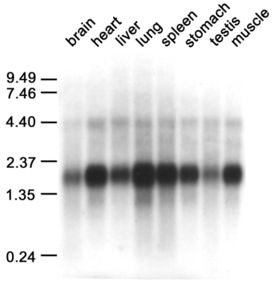
Bien que la cytoglobine se trouve dans le cytoplasme de la plupart des types cellulaires. Son taux de production révélé par la technique de Northern blot diffère d'un tissu à un autre (voir la photo ci-contre). Cette distribution de l'expression va à l'encontre d'une fonction exclusivement respiratoire attribuée à cette protéine. En effet, selon d'autres études, la cytoglobine se trouve préférentiellement synthétisée dans les cellules du tissu conjonctif (fibroblastes) et de soutien (chondrocytes et ostéoblastes) affirmant l'hypothèse selon laquelle elle serait impliquée dans la synthèse du collagène (protéine de soutien) (3). En effet, il serait concevable que la cytoglobine fournit de l'oxygène pour la prolyl-4-hydroxylase (EC 1.14.11.2) une ferroenzyme clé intervenant dans l'hydroxylation des résidus proline dans la molécule de procollagène (précurseur du collagène)[2].
En conditions d'hypoxie, la synthèse de cytoglobine est stimulée au double d'une manière plus importante dans le cœur que le foie[3]. En effet, cette globine joue le rôle classique qui est, à savoir, le stockage et le transport facilité de l'oxygène vers la chaîne respiratoire dans les mitochondries[4]. La présence de la cytoglobine dans les neurones relève beaucoup de questions sur les fonctions qu'elle pourrait jouer au niveau du système nerveux central. En effet, ce tissu possède déjà une globine spécifique, la neuroglobine. Les auteurs envisagent son rôle potentiel comme donneur d'O2 pour certaines réactions enzymatiques. entre autres, la synthèse du NO à partir de l'arginine par les NO synthases[5].
Notes et références
- Thorsten Burmester, Bettina Ebner, Bettina Weich and Thomas Hankeln, (2002). Cytoglobin: A Novel Globin Type Ubiquitously Expressed in Vertebrate Tissues. Mol Biol and Evol 19; 416-421.
- Kivirikko K. I., and Myllyharju J., (1998). Prolyl 4-hydroxylases and their protein disulfide isomerase subunit. Matrix Biol. 16; 357-368.
- Marc Schmidt, Frank Gerlach, Aaron Avivi, Thorsten Burmester et al., (2004). Cytoglobin Is a Respiratory Protein in Connective Tissue and Neurons, Which Is Up-regulated by Hypoxia. J. Biol. Chem. 279(9); 8063-8069.
- Sawai H., Kawada N., Yoshizato K., Nakajima H., Aono S., Shiro Y., (2003). Characterization of the heme environmental structure of cytoglobin, a fourth globin in humans. Biochemistry 42(17); 5133-42.
- Leone A. M., Palmer R. M., Knowles R. G., Francis P. L., Ashton D. S., and Moncada S., (1991). Constitutive and inducible nitric oxide synthases incorporate molecular oxygen into both nitric oxide and citrulline. J. Biol. Chem. 266; 23790-23795.
Annexes
Articles connexes
- Super famille des hémoprotéines.
- Famille des globines : hémoglobine, myoglobine, neuroglobine, cytoglobine.
- Structure des globines : hélice α, peptide, hème, porphyrine, liaison de coordination, fer.
- Collagène: tissu conjonctif, protéines de soutien, proline, prolyl-4-hydroxylase.
- hybridation moléculaire: ADNc, ARNm, autoradiographie, sonde moléculaire, Northern blot.
Documentation
- Cours et articles
- [PDF] Transport de l'oxygène dans le sang: Cours.
- [PDF] Cytoglobin: A Novel Globin Type Ubiquitously Expressed in Vertebrate Tissues: Découverte de la cytoglobine.
- [PDF] Cytoglobin Is a Respiratory Protein in Connective Tissue and Neurons, Which Is Up-regulated by Hypoxia: Article fondamental.
- Banques de données biologiques
- Crystal structure of human cytoglobin at 1.68 angstroms resolution : Structure 3D et modèle interactif (java) de la cytoglobine par la Protein Data Bank (RCSB PDB). Attention: Si ce lien ne fonctionne pas, effectuez vous même une recherche sur ce site avec le mot clé cytoglobin.
- Q8WWM9 Human cytoglobin gene (Swiss-Prot) : Séquence complète et autres informations sur le gène humain de la cytoglobine (CYGB) par la Swiss-Prot.
- Pubmed: Pour consulter l'actualité biologique et médicale sur ce sujet NLM.
Wikimedia Foundation. 2010.