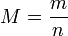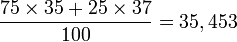- Masse molaire moléculaire
-
Masse molaire
La masse molaire est la masse d'une mole d'une substance (un corps simple, un composé chimique). Elle s'exprime en grammes par mole (g·mol−1 ou g/mol).
Cette relation se traduit par :
avec :
- n : la quantité de matière en moles (symbole « mol », selon le SI) ;
- m : la masse en grammes (symbole « g », selon le SI) ;
- M : la masse molaire en grammes par mole. (ou « g/mol » ou « g·mol−1 », selon le SI)
Sommaire
Détermination des masses molaires
Cas des corps simples
Pour chaque élément chimique, la masse d'une mole d'atomes se trouve dans le tableau périodique des éléments. Il s'agit en fait de la masse molaire moyenne pour tous les isotopes d'un élément donné, selon la proportion de chaque isotope. La valeur de la masse molaire correspond également au nombre moyen de nucléons par atome de l'élément.
Exemple : une mole d'atomes de chlore 35Cl a une masse de 35 g. Une mole d'atomes de chlore 37Cl a une masse de 37 g. L'élément chlore existe à l'état naturel avec les proportions 75,77 %/24,23 % en 35Cl/37Cl. Sa masse molaire vaut donc 35,5 g⋅mol-1 :
La masse molaire d'un corps simple est simplement le produit du nombre d'atomes dans les molécules de ce corps par la masse molaire élémentaire. Exemple : le dioxygène O2 a une masse molaire de 31,9988 g⋅mol-1, ce qui est la masse de l'oxygène multipliée par deux.
Cas des corps composés
Composés moléculaires
La masse molaire d'un composé moléculaire se calcule en additionnant les masses molaires de tous les éléments qui constituent ses molécules partie en les multipliant par les coefficients de la formule brute de ce composé.
- Exemples
- On lit dans le tableau périodique des éléments :
- MH = 1,0 g⋅mol−1 ;
- MC = 12,0 g⋅mol−1 ;
- MO = 16,0 g⋅mol−1.
- L'eau a pour formule brute H2O, soit
- Meau = 2⋅MH + MO = 2×1 + 16 = 18 g⋅mol-1.
- Le glucose a pour formule (C6H12O6), on trouve d'après les informations ci-dessous :
- Mglucose = 6×MC + 12×MH + 6×MO = 6×12,0 + 12×1,0 + 6×16,0 = 180,0 g⋅mol−1.
La masse molaire est numériquement identique à la valeur moyenne de la masse moléculaire qui est la masse d'une seule molécule et est exprimée en unité atomique (u).
Solides ioniques
Comme pour les composés molécules, il faut d'abord connaître la formule brute du solide ionique. À nouveau, on additionne toutes les masses molaires pour tous les éléments du solide en tenant compte des proportions chaque élément, et en ajoutant les molécules d'eau dans le cas des solides hydratés.
- Exemple
- sulfate de cuivre(II) hydraté CuSO4,5H2O :
- M = M(Cu) + M(S) + 4 M(O) + 5 x[2 M(H) + M(O)] = 63,5 + 32,1 + 4 x 16 + 5 (2 + 16) = 249,6 g⋅mol-1
Articles connexes
- Portail de la chimie
Catégories : Propriété chimique | Chimie générale | Unité de chimie
Wikimedia Foundation. 2010.