- Maléate
-
Acide maléique
Acide maléique Général Nom IUPAC acide (Z)-but-2-ène-1,4-dioique Synonymes acide Z-butènedioïque, acide maléique No CAS No EINECS DrugBank PubChem SMILES InChI Apparence cristaux blancs.[1] Propriétés chimiques Formule brute C4H4O4 [Isomères] Masse molaire 116,0722 g∙mol-1
C 41,39 %, H 3,47 %, O 55,14 %,pKa pKa1: 1,83 - pKa2: 6,07 Propriétés physiques T° fusion 131 °C[1] T° ébullition Se décompose au-dessous du point d'ébullition à 135 °C[1] Solubilité dans l'eau à 25 °C : 78 g/100 ml[1] Masse volumique (eau = 1) : 1.59[1] Point d’éclair 127 °C Pression de vapeur saturante < 0,1 mbar à 20 °C Thermochimie ΔfH0liquide -787 kJ/mol ΔfH0solide -791 kJ/mol Cp 136 J/mol.K (21 °C) Précautions Directive 67/548/EEC 
XnPhrases R : 22, 36/37/38, Phrases S : (2), 26, 28, 37, Transport - 1759 SIMDUT[2] Produit non classifié SGH[3] 
AttentionÉcotoxicologie LogP -0.5[1] Unités du SI & CNTP, sauf indication contraire. - Ne pas confondre avec l'acide malique
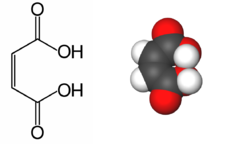
L'acide maléique est un diacide carboxylique, l'acide Z-butènedioïque. Cette molécule est le diastéréoisomère de l'acide fumarique ou acide E-butènedioïque, la configuration montre que les groupements carboxyles, caractéristiques des acides organiques sont placés sur un plan du même côté de la liaison éthylénique, c'est-à-dire de la double liaison carbone-carbone, rigide.
Les sels de ses anions et les esters sont appelés maléates.
Sommaire
Stabilité et propriétés
L'acide maléique est moins stable que son isomère fumarique, car la proximité des groupements carboxyles rend aisée une deshydratation en anhydride maléique, découverte par le chimiste Kekulé[4].
La première acidité est relativement forte, par un effet de stabilisation électronique de la base conjuguée.
L'acide maléique est un philodiène par sa liaison éthylénique, appauvrie par deux groupes voisins attracteurs d'électrons[5]. Ce philodiène participe ainsi à de nombreuses réactions avec des diènes pour former des cycles à 6 carbones.
Il donne facilement par chauffage un anhydride cyclique appelé anhydride maléique. C'est la réaction de deshydratation évoquée plus haut, qui explique le non sens de la mesure de point de fusion ou d'ébullition, signalé par le terme décomposition, puisque la molécule d'acide maléique se transforme en anhydride cyclique beaucoup plus volatile.
L'acide maléique, par sa double liaison susceptible de réaction d'addition radicalaire, est aussi un monomère. Associé à l'acide acrylique, il permet d'obtenir des copolymères acrylomaléiques, qui présentent malgré un coût élevé un intérêt en tant qu'adjuvant actifs de détergents. Leurs effets dispersants, sequestrants et légèrement tensio-actifs les proposent pour l'usage adjuvant en substitution des polyphosphates, en l'occurrence le tripolyphosphate de sodium STPP ou Na5P3O10[6].
Phrases de risque et conseils de prudence
- R: 22-36/37/38
- S: 2-26-28-37
Voir aussi
- Acide fumarique, l'isomère trans de l'acide maléique
- Liste d'acides
Notes et références
- ↑ a , b , c , d , e et f ACIDE MALEIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide maléïque » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Friedrich August Kékulé von Stradonitz savant allemand d'origine prussienne, organisateur du congrès fondateur de Karlsruhe, a initié la chimie structurale organique, en particulier le benzène et les composés de molécules carbonés cycliques communs au charbon ou au gaz de houille comportant des essences volatiles.
- ↑ Les groupes attracteurs peuvent être -COOR, -NO2, -CN , -COR.
- ↑ Les polyphosphates ne sont pas toxiques, mais sont impliqués dans l'eutrophisation. Un adjuvant actif doit éliminer les inconvénients provoqués par la dureté de l'eau, ajuster l'alcalinité de l'eau de lavage pour saponifier les salissures grasses d'origine animale et végétale, et avec ses savons formés in situ, contribuer aux caractéristiques physiques des détergents en poudre.
Liens externes
- Portail de la chimie
Catégories : Produit chimique nocif | Acide dicarboxylique | Saveur acide | Alcène
Wikimedia Foundation. 2010.