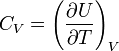- Lois de Joule
-
Loi de Joule (thermodynamique)
En thermodynamique, les lois de Joule sont deux lois de comportement d'un gaz qui énoncent respectivement que son énergie interne ne dépend que de sa température (première loi de Joule) et que son enthalpie ne dépend que de sa température (deuxième loi de Joule). Elles sont nommées d'après le physicien anglais James Prescott Joule.
Gaz parfaits
Les deux lois de Joule permettent de caractériser un gaz parfait :
- tous les gaz parfaits suivent les deux lois de Joule,
- réciproquement un gaz qui ne suit pas les deux lois de Joule n'est pas un gaz parfait.
Les expériences qui permettent de vérifier si un gaz quelconque vérifie les lois de joule sont :
- la détente de Joule et Gay-Lussac (détente à énergie interne constante) pour la première loi de Joule,
- la détente de Joule et Thomson (détente isenthalpique) pour la deuxième loi de Joule.
On peut alors énoncer qu'un gaz est parfait s'il subit ces deux détentes sans changement de température.
Traduction mathématique
La première loi de Joule énonce que l'énergie interne U ne dépend que de la température. On note CV , capacité calorifique à volume constant, la dérivée partielle de l'énergie interne par rapport à la température :
Il en découle directement une expression très utilisée en calcul de thermodynamique :
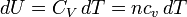 , et surtout, par intégration (puisque CV est indépendant de la température) :
, et surtout, par intégration (puisque CV est indépendant de la température) : 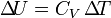 .
.La deuxième loi de Joule énonce le même résultat pour l'enthalpie H. La dérivée partielle de H par rapport à la température est noté Cp , appelée capacité calorifique à pression constante :
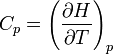 .
.
On obtient de même :
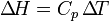 .
.On note également
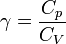 , toujours supérieur à 1, mais qui n'est pas obligatoirement constant.
, toujours supérieur à 1, mais qui n'est pas obligatoirement constant.Dans le cadre des gaz parfaits, Cp et CV sont déterminés en fonction du gaz en question : la plupart du temps, on utilise le gaz parfait diatomique, pour lequel
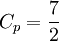 et
et 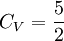 . Alors
. Alors 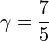 , valeur généralement utilisée.
, valeur généralement utilisée.Artciles connexes
- Loi de Joule et Gay-Lussac
- Loi de Joule-Thomson
- Relation de Mayer, section sur les gaz parfaits
- Portail de la physique
Catégorie : Loi en thermodynamique
Wikimedia Foundation. 2010.