- Deuxième loi de Joule
-
Loi de Joule-Thomson
Un gaz suit la loi de Joule-Thomson (ou deuxième loi de Joule) si son enthalpie ne dépend que de la température. L'expérience permettant de déterminer si un gaz suit la loi de Joule et Thomson est appelée détente de Joule et Thomson. Tous les gaz parfaits vérifient cette loi et aucun gaz ne vérifiant pas cette loi ne peut être parfait.
Sommaire
Conséquence sur l'équation d'état
D'après la relation de Clapeyron (cf. formules de thermodynamique), on a :
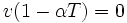 ; donc
; donc 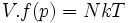
Identification de la température absolue du gaz parfait T' avec la température thermodynamique
Rappel : un gaz parfait est par définition un gaz de Joule-Thomson (V.f(p) = NkT) et un gaz de Mariotte (pV = NkT') avec T' = g(T) monotone, puisque T' est une échelle de température.
D'où f(p)/p = T/g(T) = cste ; mais quand p→0 f(p)→p donc T = g(T)= T' ; cqfd.
Critère de Joule-Thomson
On étudie une détente stationnaire d'un gaz réel dans un tuyau calorifugé où la surpression est compensée par un étranglement (en général une simple bourre de coton). Comme le régime est stationnaire, il est facile de démontrer (cf. Premier principe de la thermodynamique des systèmes ouverts) que l'enthalpie à l'entrée est égale à l'enthalpie de sortie H(p1,T1) = H(p2,T2). C'est l'expérience dite de Joule-Thomson.
C'est un critère pour savoir si un gaz est un gaz de Joule-Thomson :
- En effet s'il l'est, H(T1) = H(T2) et comme H varie de manière monotone avec T, cela entraîne T1=T2.
- Réciproquement, si T1 = T2, on aura H(p1,T1) = H(p2,T1), et cela par induction pour tout T1,ce qui revient à dire que H ne dépend pas de p.
Comportement des gaz réels
Ce fut là le triomphe de la théorie : il est facile de mesurer αT. Pour une petite détente (p1-p2), il était donc facile de prévoir T2-T1 = μ (p1-p2) où μ est appelé le coefficient de Thomson et vaut (αT − 1)V/Cp : l'expérience confirma cette prévision théorique.
Mieux encore, l'expérience prouve qu'il existe une courbe d'inversion de l'effet : échauffement si T et P sont trop élevés, ET refroidissement si T et P sont faibles. Inespéré : on avait enfin trouvé un moyen de refroidir un gaz par un système d'étranglement, SANS PIÈCE en MOUVEMENT. C'est toujours cet étranglement que l'on voit à l'arrière de nos réfrigérateurs qui fonctionnent via ce refroidissement de Joule-Thomson : un liquéfacteur est un appareil où un compresseur permet d'élever le fluide à la pression haute p1, on laisse s'évacuer la chaleur pour que le gaz revienne à la température de la pièce, d'où les ailettes noires à l'arrière du réfrigérateur qui d'ailleurs est souvent chaud (les chats aiment bien, mais mieux vaut l'éviter !). Alors le fréon se liquéfie dans la détente : on l'envoie dans le freezer immédiatement où il s'y vaporise, d'où le froid obtenu (cf. Réfrigérateur et Pompe à chaleur, pour plus de détails et les calculs).
Pour un gaz pV = NkT + Nb(T)p, traçons la courbe b(T), concave. Soit la tangente à cette courbe menée depuis l'origine et soit Ti l'abscisse de ce point : il est facile de démontrer que c'est la température d'inversion à basse pression de l'effet Joule-Thomson, elle se vérifie bien expérimentalement.
Voir théorie cinétique des gaz pour l'interprétation microscopique.
Un exercice classique est de tracer la courbe d'inversion, en coordonnées (P,T), d'un gaz de Van der Waals (voir gaz réel), c'est-à-dire le lieu des états pour lesquels αT − 1) = 0. La courbe est qualitativement juste, mais pas quantitativement : un gaz de Van der Waals est une bonne représentation de la réalité, qualitativement mais pas quantitativement.
Voir aussi
- Portail de la physique
Catégories : Article à désacadémiser | Loi en thermodynamique
Wikimedia Foundation. 2010.
