- Liaisons peptidiques
-
Liaison peptidique
Une liaison peptidique est une liaison covalente formée entre un atome de carbone d'un acide aminé et un atome d'azote d'un autre acide aminé. La liaison peptidique correspond à une fonction amide dans le cas particulier de certaines molécules biologiques.
Sommaire
Formation de la liaison peptidique
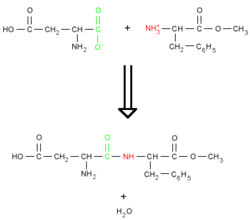
La liaison est le résultat de la réaction entre la fonction acide carboxylique COOH du premier acide aminé et la fonction amine NH2 du deuxième, avec comme produit secondaire une molécule d'eau {{H2O}}.
La liaison peptidique est fondamentale dans la formation des peptides, des polypeptides et des protéines. Après la constitution de la liaison peptidique, une extrémité est porteuse d'un groupe amine libre - l'extrémité N - ou amino-terminale, et l'autre d'un groupe carboxyl - extrémité C- ou carboxyl-terminale.Propriété de la liaison peptidique
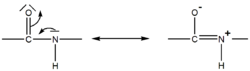
La liaison peptidique est stabilisée par mésomérie et ne peut subir de libre rotation, propriété très importante dans l'établissement de la conformation tridimensionnelle des chaînes polypeptidiques. Cette résonance implique la planéité de la liaison peptidique.
De cette structure, il découle que les groupements R des deux acides aminés reliés par la liaison peptidique sont alternés de part et d'autre de la liaison peptidique.
Rupture de la liaison peptidique
Les liaisons peptidiques peuvent être cassées par protéolyse grâce à des enzymes appelées peptidases.
Voir aussi
- Portail de la biochimie
- Portail de la chimie
- Portail de la biologie
Catégories : Biochimie | Peptide
Wikimedia Foundation. 2010.