- Liaison à 3 centres et 2 électrons
-
Liaison à trois centres et deux électrons
La liaison à trois centres et deux électrons, abrégée en liaison 3c-2e, est un modèle de description d'une liaison chimique à déficit d'électrons dans laquelle trois atomes se partagent deux électrons. Les trois orbitales atomiques forment trois orbitales moléculaires :
-
- une orbitale liante,
- une orbitale non liante,
- une orbitale antiliante.
Les deux électrons occupent l'orbitale liante, qui établit ainsi une liaison entre les trois atomes à l'origine de cette orbitale. Dans la plupart des composés qui ont des liaisons de ce type, l'orbitale liante est déplacée vers deux des trois atomes plutôt qu'elle n'est équitablement répartie entre les trois atomes.
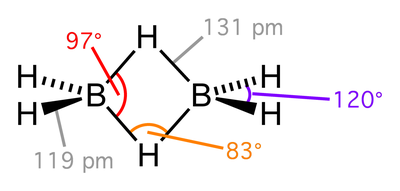
L'exemple le plus simple de structure présentant une liaison 3c-2e est le cation trihydrogène H3+[1], l'ion le plus abondant dans le milieu interstellaire. Sur Terre, les composés du bore sont les plus emblématiques des liaisons 3c-2e, notamment le diborane B2H6 :
On voit sur cette représentation de la molécule B2H6 que les liaisons B-H de type 3c-2e sont plus longues (~ 131 pm) que les liaisons B-H covalentes (~ 119 pm).
Ce type de liaison est aussi observé dans la forme dimère du triméthylaluminium Al2(CH3)6, où ce sont des atomes de carbone qui forment des ponts Al-C-Al entre deux centres Al.
Elle se retrouve également dans le digallane Ga2H6, molécule structurellement similaire au diborane.
Notes et références
- ↑ Définition d'une liaison 3c-2e dans l'IUPAC Gold Book
Article connexe
- Portail de la chimie
Catégorie : Liaison chimique -
Wikimedia Foundation. 2010.