- Lait de chaux
-
Eau de chaux
L’eau de chaux est une solution saturée d’hydroxyde de calcium (Ca(OH)2) produite en mélangeant de la chaux aérienne à de l’eau. La chaux aérienne se dissout (faiblement) dans l’eau et le filtrat obtenu constitue l’eau de chaux.
Elle se trouble en présence de dioxyde de carbone (CO2) qu'elle met en évidence. Le précipité blanc ainsi formé est du carbonate de calcium (CaCO3). La réaction est la suivante :
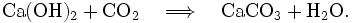
Sommaire
Fabrication
On peut en faire en petite quantité rapidement en faisant chauffer un morceau de craie à l'aide d'une flamme puis diluer la poudre obtenue dans de l'eau. Filtrer ensuite le mélange obtenu à l'aide d'un filtre à café, ou au travers de pluiseurs épaisseurs de papier absorbant dans un entonnoir. Cette méthode est souvent utilisée par les préparateurs des laboratoires de SVT.
- Le chauffage à la flamme décompose le calcaire de la craie CaCO3 (calcaire ou carbonate de calcium, solide) en CO2 (gaz carbonique ou dioxyde de carbone, gazeux) + CaO (chaux vive ou oxyde de calcium, solide).
- L'hydratation de la chaux vive donne la chaux éteinte suivant l'équation suivante: CaO + H2O (eau) → Ca(OH)2, ou hydroxyde de calcium (Chaux éteinte, solide).
- L'hydroxyde de calcium est dilué dans de l'eau, où il ne se dissout que très peu, en donnant une solution vraie Ca2+ + 2 OH-, et un excédent d'hydroxyde non dissout qui reste en suspension dans l'eau. Cette première étape aboutit à un mélange blanchâtre appelé lait de chaux. Pour éliminer la fraction non-dissoute en suspension, il faut ensuite filtrer le lait de chaux. On arrive finalement à l'eau de chaux, limpide.
Pédagogie
L'eau de chaux est fréquemment utilisée dans les cours et travaux pratiques de biologie, de géologie ou de sciences physiques. Elle sert à la mise en évidence du dioxyde de carbone par barbotage (apparition d'un précipité blanc qui "trouble l'eau de chaux").
Industrie
Le lait de chaux est beaucoup utilisé en traitement d'effluents industriels comme réactif de neutralisation des eaux acides permettant ainsi de précipiter les métaux lourds présents dans l'effluent.
En se dissociant, les ions OH- se lient aux métaux pour donner des hydroxydes métalliques insolubles en grande partie. Les ions Ca2+ peuvent se lier aux phosphates ou aux ions fluor éventuellement présents dans l'effluent pour donner du phosphate de calcium ou du fluorure de calcium.
De plus, le lait de chaux apporte une charge minérale qui permet d’obtenir des boues d’hydroxydes plus facilement filtrables dans un filtre presse par exemple.
En terme pratique, le lait de chaux, utilisé en concentration de l'ordre de 40 à 70 g/L, par sa faible solubilité (de l'ordre de 1 g/L), oblige à mettre en œuvre des circuits de distribution en agitation constante pour éviter des dépôts qui durcissent et bouchent les tuyaux.
Construction
En construction, l’eau de chaux est intéressante pour l’humidification des supports, c’est particulièrement le cas, pour la réalisation des enduits fins (stucs, taddelakt...) ou d’un badigeon.
Horticulture
En horticulture, le lait de chaux appliqué sur le tronc des arbres est un excellent antiseptique qui détruit les larves des parasites nichant sous l'écorce des arbres fruitiers (insectes), ainsi que les champignons microscopiques, qui y passent également l'hiver en attendant de développer à la saison les redoutables maladies cryptogamiques (tavelure, cloque, moniliose, chancre...).
Une application tous les 2 ans au milieu de l'hiver sur les troncs pré-brossés et jusqu'aux premières branches constitue une protection efficace.
On le trouve en bidon prêt à l'emploi sous le nom de "Blanc arboricole".
On l'applique aussi sur les parois en verre des serres pour baisser la luminosité en période estivale
Cuisine
L'eau de chaux sert en outre dans un procédé culinaire, la nixtamalisation, pour améliorer la qualité nutritionnelle de certains aliments, comme le maïs.
Cosmétique
L’eau de chaux est également utilisée dans la préparation du liniment oléo-calcaire, nettoyant naturel principalement utilisé pour le change des bébés.
Articles connexes
- Portail de la chimie
Catégories : Solution | Base
Wikimedia Foundation. 2010.
