- Amination reductrice
-
Amination réductrice
La réaction d'amination réductrice est une réaction chimique de synthèse d'amines substituées (primaires, secondaires, tertiaires), à partir d'une amine de départ (ou d'ammoniac) et de composés carbonylés.
Le produit de la réaction est une amine possédant un plus grand nombre de substituants que l'amine de départ.
Sommaire
Partenaires réactionnels
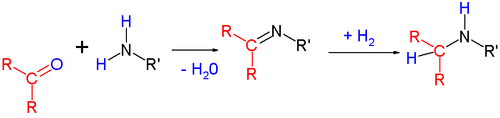
Une amination réductrice est une réaction entre trois composés, une amine, un composé carbonylé et un réducteur (donneur d'hydrogène).
Amine
L'amine peut être :
(R et R' sont des groupements quelconques)
Fonction carbonyle
La molécule comportant un groupement carbonyle peut être un aldéhyde (R-CHO) ou une cétone (RR'CO). Si la réaction est facile à mettre en œuvre avec les premiers, l'utilisation des secondes peut nécessiter des conditions de réaction spécifiques, en raison de leur plus faible réactivité.
Réducteurs
Pour obtenir l'amine, une réduction est nécessaire. Celle-ci peut être effectuée par :
- De l'hydrogène (H2) en présence d'un catalyseur (palladium sur charbon activé par exemple)
- Un hydrure (NaBH4 ou NaBH3CN par exemple).
- Un donneur d'hydrogène (acide formique ou un de ses sels).
Mécanisme
La réaction a lieu en deux étapes.
- Dans un premier temps, l'amine réagit avec le carbonylé, pour former une imine (qui peut se protonner en iminium si le milieu est acide) dans le cas de NH3 ou d'une amine primaire. Dans le cas d'une amine secondaire le seul intermédiaire possible est l'ion iminium. Cette première étape est une condensation, dans le sens qu'elle libère une molécule d'eau.
- Ensuite l'imine ou l'iminium sont réduits par le donneur d'hydrogène.
Exemples
R2NH + R'CHO +H2 → R2(R'CH2)N +H2O (en présence de catalyseur : p. ex. le palladium 10% sur charbon).
NH3 +R'2CO + → R'2CH-NH2 +H2O (en présence d'une quantité stœchiométrique de NaBH4)
RCH-NH2 +2R'CHO → RR'2N + 2H2O (en présence d'une quantité stœchiométrique de NaBHOAc3)
Voir aussi
- Amination
- Réaction d'Eschweiler-Clarke, une réaction particulière avec l'acide formique comme donneur d'hydrogène, et le formaldéhyde comme composé carbonylé
- Portail de la chimie
Catégorie : Réaction d'oxydo-réduction organique
Wikimedia Foundation. 2010.