- Formule d'Arrhenius
-
Loi d'Arrhenius
En cinétique chimique la loi d'Arrhenius permet de décrire la variation de la vitesse d'une réaction chimique en fonction de la température. Cette loi a été énoncée par Svante August Arrhenius en 1889 dans son article intitulé "On the reaction velocity of the inversion of cane sugar by acids". Mais ce n'est que vers 1910 qu'elle a été universellement acceptée par les chimistes de son temps. En effet, la loi d'Arrhenius a pu être vérifiée expérimentalement pour un grand nombre de réactions chimiques. Toutefois, toutes les réactions ne suivent pas cette loi (en particulier les réactions enzymatiques).
La loi d'Arrhenius est donc une loi empirique basée sur les résultats observés expérimentalement dans un grand nombre de cas. Elle a pris par la suite une grande importance théorique car elle est compatible avec la théorie des collisions et celle du complexe activé d'Eyring et Polanyi en 1935.
Sommaire
Énoncés
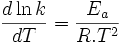 avec :
avec :- k, le coefficient de vitesse (anciennement appelé "constante de vitesse")
- T, la température en K (Kelvin)
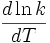 la dérivée du logarithme népérien du coefficient de vitesse par rapport à la température
la dérivée du logarithme népérien du coefficient de vitesse par rapport à la température- R, la constante des gaz parfaits (valeur usuelle R = 8,314 J.mol-1.K-1; valeur précise R = 8,314 472 Pa.m3.K-1.mol-1 recommandée par Codata)[1]
- Ea l'énergie d'activation d'Arrhenius donnée en kJ.mol-1 (ou kilo Joule par mole)
En supposant que Ea ne dépende pas de la température, ce qui n'est vrai que sur un intervalle de température limité, la loi d'Arrhenius s'intègre en :
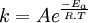
où A est le facteur pré-exponentiel (appelé aussi facteur de fréquence) tenant compte de la fréquence des collisions et des effets stériques. En première approximation le facteur pré-exponentiel ne dépend pas de la température. Des mesures plus précises effectuées sur une large plage de température montrent que A fait intervenir un facteur en T1/2 ou T3/2 selon les cas.
La forme de la loi d'Arrhenius montre que la valeur de l'énergie d'activation a l'importance prépondérante sur la vitesse des réactions. On peut dire que les réactions ayant les énergies d'activation les plus faibles sont les plus rapides et inversement celles qui ont les énergies d'activation les plus élevées sont les plus lentes.
Ordre de grandeur de l'énergie d'activation d'Arrhénius
Un grand nombre de réactions chimiques ont une énergie d'activation comprise entre 40 et 130 kJ.mol-1. Cependant certaines réactions ont des énergies d'activation faibles, voire proche de zéro, (par exemple des réactions entre ions ou radicaux) et d'autres ont des valeurs supérieures à 200 kJ.mol-1.
Dans la plage de valeur pré-citée, lorsque la température augmente de 10 °C, le coefficient de vitesse est multiplié par un facteur 2 à 3.Voici quelques exemples (réactions en phase gazeuse) :
NO + Cl2 → NOCl + Cl ; Ea = 85 kJ.mol-1
C4H6 + C2H4 → Cyclohexène ; Ea = 115 kJ.mol-1
2HI → H2 + I2 ; Ea = 184 kJ.mol-1
Cyclobutane → 2 Éthylène ; Ea = 262 kJ.mol-1
Notes et références
- ↑ CODATA value: Avogadro constant, NIST. Consulté le 2007-10-20
Voir aussi
- Portail de la chimie
Catégories : Loi en chimie | Thermochimie
Wikimedia Foundation. 2010.
